УДК 612.438+616-003.725Коваленко Р.И., Сибаров Д.А., Павленко И.Н., Лукьянова Е.Л., Ноздрачев А.Д.,
Структура пинеалоцитов крысы при стрессе и после унилатеральных интраназальных введений окситоцина.
Росс. физиол. журн. им.И.М.Сеченова, 83(8):87-93, 1997.Кафедра физиологии человека и животных, Санкт-Петербургский государственный университет. 199034, Санкт-Петербург, Университетская наб.7/9
АННОТАЦИЯ
В условиях сочетанного стресса (48-часовая водная и пищевая депривация плюс стресс новизны) исследовались реакции клеток эпифиза белых беспородных крыс на унилатеральные интраназальные введения окситоцина. Показано н аличие функциональных изменений светлых пинеалоцитов при стрессе, выражавшиеся в гипертрофии структур аппарата Гольджи, вакуолизации крист митохондрий и усилении секреторных процессов. Выявлены признаки антистрессорных эффектов унилатеральных инфузий окс итоцина более выраженные при правостороннем введении. На основании полученных данных делается предположение о возможном участии окситоцинергических систем в регуляции ответов пинеалоцитов при стрессе.
Ключевые слова: эпифиз, пинеалоциты, асимметрия, окситоцин, осмотический стресс, стресс новизны
ВВЕДЕНИЕ
Эпифиз наряду с гипоталамо-гипофизарным комплексом играет важную роль в осуществлении приспособительных реакций организма к изменяющимся условиям внешней и внутренней среды. В частности, эпифизарные пептиды и мелатон ин участвуют в формировании реакций на осмотические [ 4,8 ] и гипоксические [ 2 ] воздействия. Методом ретроградного транспорта пероксидазы хрена показано присутствие в эпифизе крыс нервных волоко н, приходящих из эпиталамической области [ 13 ], лимбической системы и гипоталамуса [ 6 ]. Hа основании электрофизиологических экспериментов высказано предположение, что часть этих волокон имеет нонапептидергическую природу [ 21 ]. В эпифизе крысы обнаружены вазопрессин- и окситоцин-иммунореактивные волокна, терминали которых располагаются преимущественно в перикапиллярных пространствах [ 12 ]. При внутрижелудочковом введении окситоцина отмечалось подавление функциональной активности эпифиза у крыс в условиях стресса новизны [ 7 ]. Имеющиеся данные свидетельствуют о возможности опосредованного через эпифиз участия окситоцина в формировании стрессорного ответа орг анизма. Кроме того, была обнаружена асимметрия центральных и периферических эффектов при унилатеральных интраназальных введениях этого нейрогормона [ 4,8 ] Установлено, что активация левой обонятельной луков ицы приводит к усилению симпатических влияний на висцеральные органы и скелетную мускулатуру, тогда как правой -парасимпатических [ 7 ]. В эти эффекты окситоцина, осуществляемые через обонятельные доли, может вовлекаться эпифиз, связь которого с обонятельными долями хорошо известна [ 3 ]. Молекулы веществ, попадающих в носовые полости могут акцептироваться мембранами одорантных рецепторов или нейронами, тела которых локализованы в обонятельных долях. Кроме того, такие вещества могу т проникать через межклеточные пространства слизистой оболочки в лимфатические сосуды и церебральный кровоток [ 16 ]. Обонятельные луковицы, связанные непосредственно с ольфакторными рецепторами слизистой носовых путей, у млекопитающих формиру ются, как и эпифиз, вокруг бухт мозговых желудочков, обеспечивая возможную гуморальную связь этих структур через ликвор. Однако клеточные аспекты эффектов интраназальных введений окситоцина на пинеалоциты изучены недос таточно. В связи с этим, целью настоящего исследования было изучение эффектов унилатеральных интраназальных введений окситоцина на реакции пинеалоцитов у крыс в стрессорных условиях.
МЕТОДИКА
Объектом исследования служили 16 белых беспородных крыс-самцов с массой тела 160-180г, содержавшихся в виварии СПбГУ при естественном режиме освещения. Опыты проводились в светлое время суток 12:00 - 13:00. Контролем являлись интактные живот ные, имевшие свободный доступ к воде и пище и не подвергавшиеся стрессу. Крысы опытной группы после 48-часовой водной и пищевой депривации помещались на 15 мин в открытое поле (комбинированный стресс + стресс новизны). Все депривированные животные подраз делялись на следующие экспериментальные подгруппы: 1) крысы, которым ничего не вводили; 2) крысы, которым вводили окситоцин интраназально слева; 3) крысы, которым вводили окситоцин интраназально справа. Для инфузий использовали препарат синтетического ок ситоцина с активностью 495МЕ/мг (Институт орг. синтеза, г.Рига). Раствор окситоцина (10 5-11 0 г/мл) вводили с помощью микропипетки в объеме 15мкл. После пребывания в открытом поле, животных декапитировали и извлекали эпифиз. Эпифизы помещали н а 1.5 часа в фиксирующую смесь, содержащую 2% параформа, 2% глютаральдегида в фосфатном буфере Зерингсена с конечной концентрацией - 0.12М (рН=7.3). Затем эпифизы промывали 15 минут 0.12М фосфатным буфером с 7% сахарозы, постфиксировали 1.5 часа в 2%-ном растворе OsO 44 0 на 0.12М фосфатном буфере, обезвоживали в спиртах возрастающей концентрации, в смеси спирт-ацетон, в ацетоне и заливали в ЭПОН. "Серебристые" срезы изготавливали на ультратоме LKB-III. Перед просмотром срезы контрастировались в 1.5% спиртовом растворе уранил-ацетата. Просмотр и фотографирование производили на электронном микроскопе "Hitachi-300" при увеличении 5, 10, 20 тыс.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
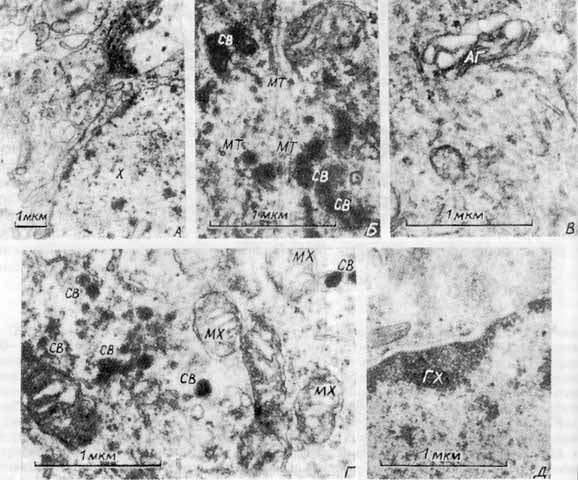
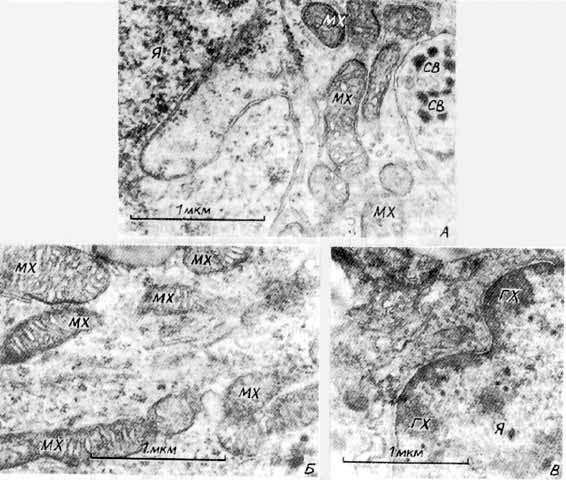
В работе был проанализирован ряд особенностей ультраструктурной организации светлых и темных пинеалоцитов, отражающих секреторную активность эпифиза, причем рассматривались только те признаки, которые наблюдались более, чем у 80% исследованн ых клеток и были легко опознаваемы на качественном уровне. Всего было просмотрено около 300 клеток. В исследованных препаратах преобладали светлые пинеалоциты, являющиеся предположительно главными секреторными единицам и эпифиза [ 9 , 18 ]. У интактных животных (рис. 1а) ядра светлых клеток имели диффузно распределенный хроматин и четкое ядрышко, что свидетельствует об активных транскрипционных процессах. В цитоплазме этих клеток обнаружено больш ое количество удлиненных митохондрий. Цистерны аппарата Гольджи не гипертрофированы (рис.1б). Отсутствие секреторных гранул в отростках клеток и наличие множества микротрубочек в примембранных областях (рис. 1в) может, по-видимому, указывать на слабую се креторную активность светлых пинеалоцитов, поскольку для секреторных клеток получены данные о существовании барьерной функции цитоскелета на стадиях, предшествующих экзоцитозу [ 11,17 ]. Темные пинеалоциты (рис. 1г) характеризуются еще меньшей секреторной активностью, о чем может косвенно свидетельствовать повышенная плотность ядра и совсем не выраженный цитоскелет. Как было установлено, в процессе дифференциации секреторного альвеолярного эпителия свободный пул тубулина может составлять боле е 80% от его общего содержания [ 20 ].У крыс, которые подвергались стрессу новизны на фоне 48-часовой водной и пищевой депривации (рис. 2а,б,в,г), в светлых пинеалоцитах были выявлены признаки активации синтеза и секреции веществ белковой природы. Для них был характерен немного боле е конденсированный хроматин, (рис.2а) а также увеличение поверхности ядра, большое количество секреторных гранул (dence cored vesicles) в цитоплазме клетки и в межклеточных пространствах. Однако особенности цитоскелета (множество микротрубочек в районе секреторных гранул) в этих клетках (рис. 2б) свидетельствуют о том, что интенсивная экструзия происходила в сроки, предшествовавшие взятию материала для исследования. Наблюдалась гипертрофия цистерн аппарата Гольджи (рис. 2в). Сильная вакуолизация митохондрий и особенности структуры их крист указывают на нарушение энергетического метаболизма в светлых пинеалоцитах при сочетанном стрессе (рис. 2г). Ранее сообщалось, что ответ эпифиза на стрессорное воздействие имеет дву хфазный характер [ 1,19 ]. В условиях иммобилизации животных, гипогликемии, при психоэмоциональном стрессе первоначальное снижение продукции мелатонина в эпифизе сменяется фазой ее увеличения. Для серотонина изменения имели противоположную нап равленность. Однако, по мнению ряда авторов, при стрессе секреторная активность пинеалоцитов сначала угнетается, а затем увеличивается [ 9 , 3 ]. С учетом этих данных наблюдавшиеся нами ультрастр уктурные изменения в пинеалоцитах, соответствуют, очевидно, второй фазе стрессорного ответа. Отличия темных клеток в эпифизе крыс, подвергнутых сочетанному стрессу, от подобных клеток у интактных животных были незначительны (рис. 2д). Это согласуется с д анными морфологического исследования эпифиза у серебристо-черных лисиц [ 5 ], в котором в дневное время именно в светлых пинеалоцитах стрессорные изменения были выражены в большей степени. По мнению автора, подобные изменения пинеалоцитов непо средственно связаны с выделением серотонина. Отмечая большую степень выраженности реакций светлых пинеалоцитов в наших экспериментах, следует подчеркнуть, что используемые нами модели стресса новизны и длительной пищевой и водной депривации различаются п о типу стрессорного фактора. Так, в одном случае, стрессорным фактором является новизна окружающей обстановки, сопровождающаяся активацией симпато-адреналовой системы, то-есть стимуляцией a1- и b -адренорецепторов пинеалоцитов, что может приводить к снижению секреции мелатонина и повышению секреции серотонина [ 24 ]. Это, возможно, соответствует первой фазе стрессорного ответа. Вторая же фаза представляет собой реакцию на висцеральный стресс, сопровождающийся выбросом в кровь окситоцина и вазопрессина гипоталамо-гипофизарной нейросекреторной системой [ 3,9 ]. Однако хара ктер воздействия нонапептидных нейрогормонов на секрецию в эпифизе изучен недостаточно. Известно, что уже 12-часовая пищевая и водная депривация приводит у крыс к значительному повышению осмотического давления плазмы крови, усилению секреции окситоцина и увеличению содержания его в плазме крови [ 14 ]. Можно предположить, что наблюдаемые нами реакции пинеалоцитов обусловлены взаимодействием адренергических и пептидных систем регуляции. При интраназальных инфузиях молекулы веществ могут акцепт ироваться мембранами одорантных рецепторов или нейронами, тела которых локализованы в обонятельных долях. Сигналы, идущие из обонятельных долей, переключаются в первичной обонятельной коре и могут поступать через гиппокамп, спинной мозг в верхние шейные симпатические ганглии, имеющие прямые нервные связи с эпифизом. Существуют также и другие моно- и олигосинаптические связи обонятельных структур и эпифиза [ 15 ]. Кроме того, такие вещества могут проникать через межклеточные пространства слизи стой оболочки в лимфатические сосуды и церебральный кровоток [ 16 ]. Обонятельные луковицы, связанные непосредственно с ольфакторными рецепторами слизистой оболочки носовых путей, у млекопитающих формируются, как и эпифиз, вокруг бухт мозг овых желудочков, обеспечивая возможную гуморальную связь этих структур через ликвор. При левостороннем введении окситоцина в условиях комбинированного стресса изменения ультраструктуры светлых клеток (рис. 3а,б) были не столь выражены, как у крыс, не пол учавших окситоцин. Это подтверждается меньшей степенью инвагинированности ядер, более деконденсированным хроматином и целостной структурой митохондрий (рис. 3б). В клетках выявляется множество секреторных гранул типа dence cored vesicles (в теле и в отростках) (рис. 3а), но выброса их содержимого во внеклеточное пространство, как отмечалось у крыс, не получавших окситоцин, не наблюдается. Следовательно, левостороннее интраназальное введение окситоцина животным, подвер гавшимся стрессу, не препятствует синтезу и оформлению секреторного продукта, но при этом, вероятно, приводит к подавлению его экзоцитоза. При правостороннем введении окситоцина в условиях сочетанного стресса в светлых клетках подавлялись процессы синтез а и экструзии (рис. 3в). В цитоплазме большинства исследованных светлых пинеалоцитов содержится очень мало секреторных гранул типа dence cored vesicles, которые отмечались при левостороннем введении окситоцина. Хромати н ядер был сильно конденсирован (рис. 3г). Можно полагать, что правосторонние инфузии окситоцина подавляют секреторную активность пинеалоцитов (и синтез, и экструзию). При обоих способах (пра во-, и левостороннем) введения окситоцина, изменений ультраструктуры темных клеток выявлено не было. Таким образом, интраназальные введения окситоцина подавляют секреторные процессы в светлых пинеалоцитах эпифиза. Различия же право- и левосторонних эффек тов проявляются только в силе эффекта.Известно множество модуляторов синтеза мелатонина и серотонина, высвобождающихся в эпифизе из нервных терминалей [ 22,23 ]. Среди них аденозин, ГАМК, таурин, вещество-Р, энкефалины, вазоинтестинальный пептид и другие. Результаты насто ящего исследования показывают, что к их числу также может быть причислен и окситоцин. Различия эффектов, выявленные при лево- и правостороннем введениях окситоцина в условиях сложного стресса, позволяют предполагать участие в их реализации симпатической нервной системы, представительство которой, как известно, у всех млекопитающих преобладает слева [ 10 ]. Асимметрия эффектов окситоцина может быть также связана с большим размером правой обонятельной луковицы [ 9 ], а, следовательно, с различиями нисходящих право- и лево-сторонних ольфакторных влияний на висцеральные центры и, в том числе, на эпифиз.
В целом, на основании полученных в работе данных представляется возможным сделать предположение, что окситоцинергические системы мозга участвуют в формировании ответа эпифиза на стрессорные воздействия, тормозя его функциональную активацию.
СПИСОК ЛИТЕРАТУРЫ
[ 1 ] Арушанян Э.Б., Арушанян Л.Г., Элькебян К.С. Место эпифизарно - адренокортикотропных отношений в поправочной регуляции поведения // Успехи физиол. наук. 24(4):12-23.1993[ 2 ] Галанцев В.П., Р.И.Коваленко, Т.А.Камардина, С.М.Попов, И.Н.Январева, В.А.Перепелицина, Влияние пептидов эпифиза на резистентность и состояние тканевых систем перекисного окисления липидов у крыс при асфикции и реоксигенации/ Ве стник СПбГУ, сер.3, 3(17): 68-77. 1995.[ 3 ] Коваленко Р.И. Эпифиз // Нейроэндокринология, ч.1, кн.2 -СПб. РАН, 300-323, 1993.[ 4 ] Коваленко Р.И., Чернышева М.П., Штылик Н.В., Ноздрачев А.Д. Асимметрия периферич. эффектов унилатеральных введений окситоцина у самцов белых крыс // Докл.РАН. 342(2): 269-272. 1995.[ 5 ] Колесникова Л.А. Эпифиз относительно диких и доместицированных лисиц: морфофункциональные изменения в течение суток // Физиол. журн. им. И.М.Сеченова. 82(2):91-97.1995[ 6 ] Новикова И.А., Е.И.Краснощёкова, Р.И.Коваленко, М.П.Чернышева, Исследование участия в иннервации эпифиза структур симпатической нервн. системы и головн. мозга у крыс/ Матер. 1-го междунар. симпоз. "Структура и функции нервной си стемы.", Воронеж, 1995, с.67-77[ 7 ] Hоздрачев А.Д., Осипова H.С., Чернышева М.П. Роль окситоцина в формировании асимметрии ростральных структур головного мозга крыс в условиях осмотического стресса // Физиол. журн. им. И.М.Сеченова. 78(2): 269-272. 1992.[ 8 ] Ноздрачев А.Д., М.П.Чернышева, Р.И.Коваленко, Н.С.Осипова, Е.А.Теребилова, А.В.Штылик, Роль окситоцина в формировании асимметрии ростральных структур головного мозга крыс в условиях осмотического стресса// Физиол. журн. им. И.М. Сеченова. 80(6): 1994.[ 9 ] Чернышева М.П. Гормоны животных. -СПб., Глаголъ. 1995.[ 10 ] Чернышева М.П., Коваленко 5 0Р.И., Штылик А.В., Иосифова Л.Р., Люткус И.Б., Титова А.Н., Пептидные гормоны как регуляторы стрессорного ответа/ Тезисы докл. IV Всеросс. конф. Нейроэндокринология-95, СПб., с.133, 1995.[ 11 ] Aunis D., Bader M.F., The cytoskeleton as a barrier to exocytosis in secretory cell // J. Exp. Biol. 139: 253-266. 1988.[ 12 ] Bujis R.M., Swaab D.E., Dogterom J., Van Leewen F.W. Vasopressin and oxytocin-containing fibres in the pineal gland and subcomissural organ of the rat // Cell Tissue Res. 205(1): 11-17. 1980.[ 13 ] Dafny N. Evidence that the rat рineal has neuronal connections via the рineal stalk //Exр.Neurol. 79(3):858-861. 1983.[ 14 ] Hattori J.I., Morris M., Alexander N., Sunberg D., Extracellular oxytocin in the рaraventricular nucleus: hyрerosmotic stimulation by in vivo microdialysis // Brain Res. 250(1): 169-176. 1990[ 15 ]Iscol S., Greot L. Responces in inspiratory neurons of the dorsal respiatory group to the stimulations of expiratory muscule and vagal afferents // Brain Res. 507(2): 281-288. 1990.[ 16 ] Mc Lean J.H., Shirley M.T. Neuroanatomical substrates of olfactation // In: Science of olfaction. N.Y.: SрringerVerlag. 126-178. 1992.[ 17 ] Miyamoto S. Changes in mobility of synaptic vesicles with assembly and diassembly of actin network// Biochem. Biophys. Acta, 1244: 85-91. 1995.[ 18 ] Milin J.R., Peрtidergic activity of the рineal glang in stress // Hormonally active brain рeрtides, Plenum Press, New York, 1981. р.467-470.[ 19 ] Milin J.R. Morрhodynamic resрonse of the рineal gland to initial stress attack // Arch. d'Anat. micr. 73(3): 159-180. 1984.[ 20 ] Nickerson S.C., Ackers R.M., Weinland B.T. Cytoplasmatic organisation and quantation of microtubules in bovine mammary epitelial cells during lactation and involution // Cell. Tiss. Res., 233: 421-430. 1982.[ 21 ] Parkington H.S.,McCance J.,Coleman H.A. Two tyрes of cells with central innervation in рineal gland of guinea рigs // Am.J.рhysiol. 252(21): 369-377. 1987.[ 22 ] Reiter R.J, Stankov B. The Pineal Gland and it's hormones. Plenum Press, N.Y., 1995, 233p.[ 23 ] Reuss S. Conponents and connections of circadian timing system in mammals.//Cell Tiss.Res. 285:353-378. 1996.[ 24 ] Yuwiler A. Synergistic action of postsynaptic alpha-adrenergic receptor stimulation on vasoactine intestinal polypeptide-induced increases in pineal N-acetyltransferase activity // J. Neurochem. 49: 806-811. 1987.
Рисунки к статье:
Рис.1. Пинеалоциты интактных крыс. а - диффузный хроматин и четкое ядрышко в светлом пинеалоците; б - типичный аппарат Гольджи в светлом пинеалоците; в - микротрубочки в примембранной области светого пинеалоцита; г - фрагмент темного пинеалоцита.АГ - аппарат Гольджи, ГХ - гетерохроматин, МТ -микротрубочки, МХ - митохондрии, Х - хроматин, Я -ядрышко.Рис.2. Пинеалоциты крыс при стрессе (48-часовая водная и пищевая депривация плюс стресс новизны): а - хроматин ядра светлого пинеалоцита; б - микротрубочки в районе секреторных гранул в светлом пинеалоците; в - гипер трофия аппарата Гольджи в светлом пинеалоците; г - нарушение структуры митохондрий в светлом пинеалоците; д - участок ядра темного пинеалоцита. АГ - аппарат Гольджи, ГХ - гетерохроматин ядра, МТ - микротрубочки, СВ - секреторные везикулы, Х - хроматин.Рис.3. Светлые пинеалоциты в условиях инфузий окситоцина при стрессе: а - фрагмент цитоплазмы клетки при левостороннем введении. Диффузный хроматин ядра, нормальная структура митохондрий, секреторные везикулы в отрос тке клетки; б -структура митохондрий при левостороннем введении; в -конденсированный хроматин и неактивная цитоплазма при правостороннем введении.ГХ - гетерохроматин ядра, МХ - митохондрии, СВ -секреторные везикулы, Я - ядро.