Сибаров
Д.А., Вольнова А.Б., Фролов Д.C., Ноздрачев А.Д.
ВЛИЯНИЕ ИНТРАНАЗАЛЬНОГО ВВЕДЕНИЯ ЭПИТАЛОНА НА НЕЙРОНАЛЬНУЮ АКТИВНОСТЬ
НЕОКОРТЕКСА КРЫС
Росс.Физиол.журн., 2006, 92(8): 949-956.
Лаборатория физиологии рецепции, Институт физиологии им. И.П.Павлова РАН
Россия, 199034, Санкт-Петербург, наб. Макарова 6.
Лаборатория нейробиологии развития, Институт физиологии им. А.А.Ухтомского
Россия, 199034, Санкт-Петербург, Университетская наб. 7/9.
В работе рассматривались свойства синтетического тетрапептида эпиталона (Ala-Glu-Asp-Gly), синтезированного на основе пептидного экстракта эпифиза. Интраназальный способ введения препарата был выбран как неинвазивный путь доставки препарата в ЦНС в обход гематоэнцефалического барьера. Целью работы была оценка характера воздействия эпиталона на частоту спонтанной активности нейронов коры мозга белых крыс. В работе использовались крысы-самцы линии Вистар, наркотизированные введением раствора уретана (1 г/кг). Внеклеточная активность корковых нейронов регистрировалась при помощи стеклянного микроэлектрода с сопротивлением 1-2 МОм. После регистрации спонтанных нейронных разрядов в течение 10-15 минут производили интраназальное введение раствора эпиталона, регистрируя нейронную активность вплоть до 30 минут после введения препарата в дозе 20 нг на животное. Через несколько минут после инфузии наблюдалась значительная активация нейронной активности, выражавшаяся в увеличении (в 2-2,5 раза) частоты разрядов. В ряде опытов эффект эпиталона был многофазным. За первым пиком увеличения частоты нейронных разрядов на 5-7 минуте следовали пики в 11-12, 17-18 минут. Увеличение частоты разрядов происходило за счет повышения частоты разрядов уже активных нейронов, а также вовлечения ранее молчащих. Показано, что по крайней мере первый пик усиления нейронной активности при действии эпиталона связан с прямым действием пептида на клетки коры.
Ключевые слова: эпиталон, неокортекс, микроэлектрод, интраназальное введение, пептид.
ВВЕДЕНИЕТканеспецифические короткие пептиды, получившие общее название «цитомедины», выделены на сегодняшний день из гипоталамуса, эпифиза, тимуса, неокортекса и многих других отделов мозга. Показано, что цитомедины - вещества с высокой адаптогенной активностью, онкостатики, геропротекторы и стимуляторы процессов регенерации. [5,6,14]. Они привлекают все большее внимание исследователей как новый класс регуляторов иммунных и нейроэндокринных процессов в центральной нервной системе.
Эпиталамин - один из первых низкомолекулярных пептидных комплексов, полученный методом уксуснокислой экстракции из эпиталамо-эпифизарной области мозга. Он обладает выраженными онкостатическими, геропротекторными, антиоксидантными и адаптогенными свойствами [1]. В последние годы показано, что пептидные препараты эпифиза активно воздействуют на метаболизм ЦНС и неврологические показатели животных и людей [3]. У крыс, которым вводили эпиталамин, отмечена активация продукции мелатонина [2], что приводило в свою очередь к нормализации циркадных ритмов и увеличению резистентности организма. Заместительное введение эпиталамина полностью устраняло нарушения памяти и обучаемости у крыс, наблюдаемые в результате дефицита продукции эпифизом пептидных гормонов при старении [7]. Применение эпиталамина у пожилых пациентов улучшало показатели выполнения нейропсихологических тестов – возрастание темпов моторных реакций, улучшение зрительно-моторной координации, уменьшение времени выполнения заданий, улучшение памяти [3].
Для клинического применения особый интерес представляет синтетический пептидный препарат эпиталон (Ala-Glu-Asp-Gly), сконструированный на основании анализа аминокислотного состава экстракта эпифиза эпиталамина [14]. Также как и его предшественник, он является сильным онкостатиком, антиоксидантом и геропротектором [9,10,12]. При этом физиологические свойства эпиталона проявляются при существенно меньших дозах, чем у эпиталамина [11].
Сведения о защитном действии пептидов эпифиза на ЦНС получены, главным образом, при внутривенном введении эпиталона или эпилаламина, а также при прямой аппликации этих веществ в культуры ткани. Однако проникновение пептидных веществ в мозг при внутривенном введении ограничено существованием гематоэнцефалического барьера. Многочисленными исследованиями показано, что ряд веществ, включая металлы, красители, вирусы, низкомолекулярные пептиды [15], проникают в мозг через обонятельную систему, минуя гематоэнцефалический барьер [13]. Поэтому с точки зрения возможного клинического применения цитомединов является весьма оправданным использование интраназального введения как неинвазивного способа доставки этих пептидов в ЦНС. Ранее нами было обнаружено, что интраназальное введение эпиталона приводило к достоверному повышению содержания в эпифизе крыс белка С-Fos, являющегося одним из триггеров, запускающих секреторные процессы в этих клетках [16] а также вызывало 2-3 кратное увеличение частоты импульсной активности пинелоцитов эпифиза [8]. Физиологическая активность препарата в весьма низкой концентрации 10-10-10-14 М дает основания предполагать, что действие эпиталона основано на связывании с неизвестным рецептором.
На сегодняшний день практически не изучены механизмы воздействия эпиталона на ЦНС при интраназальном введении, в частности, на возбудимость нейронов центральных мозговых структур. Задачей данной работы является изучение такого влияния. Конкретной целью работы было охарактеризовать в динамике воздействие интраназального введения эпиталона на электрическую активность нейронов неокортекса.МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования служили 17 крыс-самцов Вистар массой 180-200 г. Эксперименты проводили во второй части светового дня с 15.00 до 18.00. Животное наркотизировали внутрибрюшинным введением раствора уретана (1 г/кг), затем производили билатеральную краниотомию от 0 до 3 мм фронтально по отношению к брегмальному шву и до 2 мм латерально от сагиттального шва. Крысу закрепляли в стереотаксическом аппарате и в исследуемую область неокортекса вводили стеклянный микроэлектрод, заполненный насыщенным раствором цитрата натрия, с сопротивлением 1-2 МОм. Индифферентным электродом служила хлор-серебряная пластина, помещенная в область скальпирования. Внеклеточная активность нейронов коры регистрировалась начиная с глубины погружения микроэлектрода 700 мкм. Сигнал с микроэлектрода поступал на усилитель ML319, далее оцифровывался с частотой дискретизации 30 КГц через АЦП MD93 для последующего анализа параметров мультиклеточной активности в разработанной нами программе “Bioactivity Recorder v 4.0”.
Идентификация нейронов в мультиклеточной записи проводилась на основании исследования формы отдельных потенциалов действия (амплитуда, продолжительность деполяризации, продолжительность реполяризации, наличие или отсутствие пачек импульсов). Применение кластерного анализа (алгоритм KlustaKwik) позволяло выделить от 2 до 8 категорий импульсов, из которых одна категория всегда составляла низкоамплитудный шум, а остальные соответствовали “голосам” 1-7 нейронов.
Интраназальное введение эпиталона производили билатерально, регистрируя нейронную активность до и после введения в течение 10 – 30 минут. Для определения пороговой дозы эпиталона в четырех первых экспериментах вводили 2 мкл раствора по 1, 5, 10, 20 и 50 нг на крысу, регистрируя последующую нейронную активность неокортекса вплоть до 20 минут после введения (исследовано 38 нейронов). В последующих 14 экспериментах для интраназального введения использовалась найденная пороговая доза. В большинстве опытов с интервалом в 40-60 минут проводили повторное введение исследуемых веществ с регистрацией наблюдаемых эффектов. На одном животном удавалось зарегистрировать воздействие аппликации эпиталона (опыт) или физиологического раствора (контроль) на 30-40 нейронов. Всего было идентифицировано 322 нейрона в опыте и 55 в контроле.
В трех экспериментах эпиталон добавлялся в раствор для заполнения микроэлектродов (цитрат натрия), в конечной концентрации 10-11 М. Микроэлектрод закреплялся в герметичном держателе, соединенном с поршнем. Регистрация активности нейронов проводилась до и после микроинъекции эпиталона в межклеточную среду (0,5 мкл, судя по смещению мениска жидкости в микроэлектроде). Всего идентифицировано 60 нейронов.
В ходе статистической обработки абсолютные значения частоты нейронных разрядов в опыте (после введения) переводились в проценты от фоновой активности (до введения). После этих преобразований значения частот разрядов нейронов в промежутках времени до инфузии эпиталона, а также на 1-3 мин, 5-7 мин, 9-12 мин распределены нормально, что позволяет применять критерий Стьюдента для оценки различий между частотой разрядов нейронов в эти периоды времени.РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
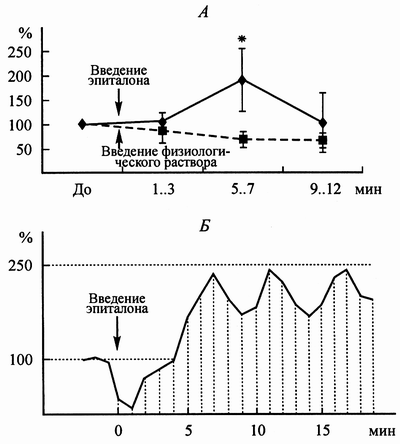
Исследование эффектов интраназального введения эпиталона в условиях острого физиологического эксперимента показало, что частота спонтанной нейрональной активности, регистрируемой в области теменного и фронтального неокортекса, достоверно изменялась. По результатам четырех экспериментов пороговая доза при интраназальной аппликации эпиталона составила 20 нг на животное. В зависимости от уровня наркоза и глубины погружения микроэлектрода абсолютные частоты разрядов нейронов в разных опытах значительно варьировали, однако сохранялась общая тенденция увеличения частоты после введения эпиталона. Рисунок. 1а иллюстрирует эту тенденцию по результатам усреднения данных, полученных в 12 экспериментах, показывая достоверное увеличение частоты нейронных разрядов через 5-7 минут после введения эпиталона по сравнению с фоновой активностью до введения вещества. Контрольное введение физиологического раствора не приводило к достоверным изменениям этого показателя. Значимое уменьшение средней частоты импульсов через 9-12 минут после аппликации как эпиталона, так и контрольного введения физраствора, связано, по-видимому, с повреждающим действием длительного микроэлектродного отведения на окружающую корковую ткань.
В разных опытах частота разрядов достигала максимума с небольшим сдвигом во времени. На рисунке 2 представлена суперпозиция графиков изменения частоты разрядов 6 отдельных нейронов, зарегистрированных в разных опытах.
В четырех опытах реакция нейронов коры на интраназальное введение раствора эпиталона состояла из нескольких фаз. На рисунке 1б представлен пример динамики изменения частоты разрядов в таком опыте. В первые три минуты после введения частота не возрастала или даже снижалась. Мы считаем это неспецифической реакцией на раздражение обонятельного эпителия, которая с равным успехом вызывалась интраназальным введением физиологического раствора. Достоверное усиление импульсной активности нейронов в большинстве опытов происходило на 5-7 минуте после введения эпиталона. Как видно из рисунка, после интраназального введения эпиталона частота разрядов нейронов достигала уровня 200 - 250 % от фона. Усиление активности нейронов коры было непродолжительно и угасало на 8-9 минуте после введения эпиталона, иногда наблюдали еще две или три фазы увеличения частоты разрядов нейронов. За первым пиком увеличения частоты в районе 5-7 минуты следовали пики в районе 11-12, 17-18 минут (рис. 1б). К сожалению, природа такой многофазной реакции еще неясна. Появление двух, трех и более пиков увеличения активности нейронов может быть связано с опосредованием его эффекта через другие отделы ЦНС.
Во всех опытах общая частота разрядов стабилизировалась или возвращалась к контрольному уровню не позднее, чем через 30 минут.
Итак, при интраназальном введении эпиталона временная задержка с момента интраназального введения эпиталона до появления реакции нейронов коры составила в среднем 5-6 минут. Мы предполагаем, что эпиталон попадает в мозговой кровоток, а наблюдаемая нами задержка связана со временем транспорта пептида к исследованному участку коры. Ранее в гистологическом исследовании нами было показано проникновение флюоресцентно меченого эпиталона в мозг через кровоток и связывание его с отдельными нейронами [4]. Кроме того, интраназально введенное вещество попадает и во множество других отделов ЦНС, в некоторые позднее 5 минут, в некоторые раньше [15]. В этом случае физиологический эффект эпиталона может быть опосредован через другие отделы ЦНС и не быть связанным с прямым действием тетрапептида на нейроны коры.
Для проверки такой возможности было поставлено дополнительно 4 опыта с прямой микроинъекцией раствора эпиталона (10-11М) в межклеточную среду через кончик микроэлектрода. При прямом действии эпиталона на нейроны, прилежащие к кончику электрода (Рис. 3а и 3б) эффект усиления активности нейронов (увеличение частоты на 400±211%) наблюдался уже через 10-20 секунд после микроинъекции и был аналогичен таковому при интраназальном введении, но без 5-минутной задержки. Таким образом, мы можем предполагать, что эпиталон воздействует непосредственно на клетки неокортекса, и, по крайней мере, первый пик увеличения частоты разрядов нейронов при интраназальном введении связан с прямым действием эпиталона на кору и не опосредован через другие системы.
Собственно увеличение суммарной частоты разрядов состояло, как минимум, из двух компонентов. Во-первых, возрастала частота разрядов уже активных клеток и, во-вторых, включались ранее молчащие нейроны. Пример этого процесса можно видеть на рисунке 4, на котором приведен пример записи нейрональной активности клеток неокортекса до (А) и через 8 минут после (Б) интраназальной аппликации эпиталона. Нейроны 1 и 2 реагируют на экспериментальное воздействие увеличением частоты разрядов, а нейроны 3 и 4 (ранее молчащие) проявляют свою активность лишь после воздействия эпиталона. Кроме того, в наших экспериментах зарегистрирована популяция нейронов, для которых не удалось установить зависимость частоты разрядов от действия эпиталона. Наибольший статистический вес в изменении суммарной частоты разрядов под действием эпиталона принадлежал клеткам с одиночным типом разрядов. Достоверного увеличения числа импульсов в пачках до и после введения эпиталона обнаружить не удалось.
По нашему мнению, увеличение частоты спонтанной нейронной активности неокортекса крыс под действием эпиталона может быть связано со снижением порогов возбудимости корковых нейронов и с ослаблением процессов торможения в коре. Несмотря на то, что механизм осуществления этого эффекта требует дальнейших исследований, полученные нами факты могут представлять интерес при клиническом применении эпиталона для лечения нарушений деятельности ЦНС.
ВЫВОДЫ· Через 5-7 мин после интраназального введения раствора эпиталона происходит кратковременное (на 2-3 мин) увеличение частоты разрядов нейронов неокортекса крыс.
· Интраназальное введение эпиталона вызывает появление нескольких волн увеличения частоты разрядов нейронов с периодом 3-4 минуты; наблюдаемый эффект сходит на нет не позднее, чем через 30 минут после введения.
· Общее усиление импульсной активности нейронов происходит за счет повышения частоты разрядов активных нейронов, а также вовлечения ранее молчащих.
· По крайней мере первый пик усиления импульсной активности нейронов при действии эпиталона связан с прямым действием пептида на клетки коры.Работа поддержана грантом Фонда содействия отечественной науке.
СПИСОК ЛИТЕРАТУРЫ[1] Анисимов В.Н. Молекулярные и физиологические механизмы старения. – СПб. Наука, 2003, С.284-302, 2003.
[2] Бондаренко, Л. A., Анисимов, В. Н. Возрастные особенности влияния эпиталамина на метаболизм серотонина в эпифизе крыс. Бюлл. Эксп. Биол. Мед., 113: 194 – 195, 1992.
[3] Коркушко О.В., Хавинсон В.Х., Бутенко Г.М., Шатилов В.Б. Пептидные препараты тимуса и эпифиза в профилактике ускоренного старения. СПб: Наука, С.109-111, 2002.
[4] Лапина Е.А, Назарова Л.А, Петрова О.П, Сибаров Д.А., Зубжицкая Л.Б., Павлова Н.Г., Константинова Н.Н., Коновалов Я.С., Кветной И.М., Арутюнян А.В., Григорьев Е.И. Флюоресцентно-микроскопическое исследование связывания эпиталона тканями матери и плода у кроликов в норме и в условиях плацентарной недостаточности. Бюлл. эксп. биол. и мед. 139 (5): 578-581, 2005.
[5] Морозов В.Г., Хавинсон В.Х. Новый класс биологических регуляторов многоклеточных систем – цитомедины. Усп. Совр. Биол., 1983, 9(3): 339-340, 1983.
[6] Морозов В.Г., Хавинсон В.Х. Пептидные биорегуляторы (25-летний опыт экспериментального и клинического изучения). СПб, Наука, 1996.
[7] Рыбников В.Ю., Закуцкий Н.Г. Пептидная регуляция функций мозга. СПб., 2000.
[8] Сибаров Д.А. Стимуляция эпиталоном и эпиталон-дансилом пинеалоцитов крысы при интраназальном введении Материалы III Всероссийской конференции "Механизмы функционирования висцеральных систем" (29 сентября-1 октября 2003, Санкт-Петербург), 299-300, 2003
[9] Хавинсон В. Х., Голубев А. Г. Старение эпифиза. Успехи геронтологии 9: 259-265, 2002.
[10] Хавинсон В.Х., Анисимов В.Н. Синтетический пептид эпифиза увеличивает продолжительность жизни и угнетает развитие опухолей у мышей. Докл. АН, 374(5): 710-711, 2000.
[11] Хавинсон В.Х., Мыльников С.В. Влияние тетрапептида эпифиза на состояние антиоксидантной защиты у Drosophila melanogaster. Бюлл., эксперим. биол. и мед., 129(4): 420-422, 2000.
[12] Хавинсон В.Х., Яковлева Н.Д., Попучиев В.В., Кветной И.М., Манохина Р.П. Репаративное действие эпиталона на ультраструктуру пинеальной железы гамма-облученных крыс. Бюл. эксперим. биол. и мед., 131(1):98-104, 2001.
[13] Chen X. et al., Delivery of Nerve Growth Factor to the Brain via the Olfactory Pathway.J. of Alzheimer’s Disease 1:35-44, 1998.
[14] Khavinson V.Kh, Morovov V.G. Novel approaches to the prevention ant treatment of age-associated pathology using peptide bioregulators – Epithalamin and Thymalin. Aging in the Americas: Frontiers of Care, Policy and Research. Abstr. Of pan-American Congress. San-Antonio, P.46, 1999.
[15] Pietriwski R., Thiemann A., Kern W., Fehm H., Born J. A nose-brain pathway for psychotropic peptides: evidence from a brain evoked potential study with cholecystokinine. Psychoneuroendocrinology, 21:559-572, 1996.
[16] Sibarov D.A., Kovalenko R.I., Malinin V.V., Khavinson V.Kh. Epitalon Influences Pineal Secretion in Stress-Exposed Rats in the Daytime. Neuroendocr. Lett., Dec., 23(5/6): 473-475, 2002.Рис. 1. Динамика изменения частоты спонтанной нейронной активности коры при интраназальном введении эпиталона, стрелка показывает момент введения; А) средняя частота разрядов нейронов при введении эпиталона и физиологического раствора, * - достоверные различия (P<0,05); Б) пример изменения частоты разрядов в одного нейрона. По горизонтали – время в минутах; по вертикали – частота нейронных разрядов в процентах к фоновой.
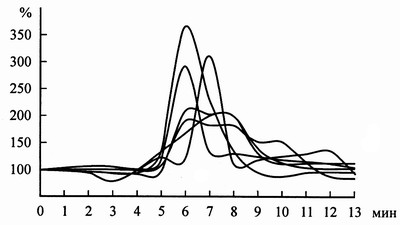
Рис. 2. Суперпозиция графиков изменения частоты разрядов нейронов с момента интраназального введения эпиталона. По горизонтали – время с момента аппликации эпиталона в минутах; по вертикали – частота нейронных разрядов в процентах к фоновой.

Рис. 3. Динамика изменения частоты спонтанной нейронной активности коры при прямой аппликации раствора эпиталона, стрелка показывает момент введения; Обозначения как на рис. 1.
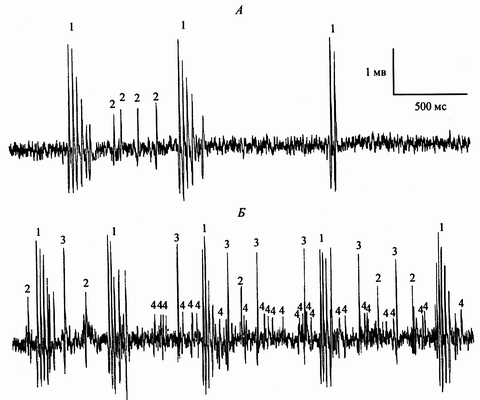
Рис. 4. Пример мультиклеточной записи разрядов нейронов до (А) и на 5-й минуте после (Б) интраназального введения эпиталона. Цифрами обозначены разряды отдельных идентифицированных нейронов.
INTRANASAL EPITALON INFUSION MODULATES ELECTRIC ACTIVITY OF RAT NEOCORTEX
D.A. Sibarov, A.B. Vol'nova, D.S. Frolov, A.D.Nozdrachev
Physiology of Reception Laboratory, I.P.Pavlov Institute of Physiology RAS.
Russia, 199034, St.Petersburg, Makarova 6.
Developmental Neurobiology Laboratory, A.A.Ukhtomsky Institute of Physiology.
Russia, 199034, St.Petersburg, University emb. 7/9.In the paper the properties of tetrapeptide epitalon (Ala-Glu-Asp-Gly) constructed on the basis of pineal peptide extract, have been observed. The intranasal infusions as noninvasive way to deliver this peptide to CNS in pass-by of the blood-brain barrier has been used. The aim of the study is to estimate epitalon action on rat motor cortex spontaneous activity. Wistar male rats were urethane anesthetized (1g/kg). Extracellular neural recordings were made using glass microelectrodes (1-2 MOhm). After recording of spontaneous activity (10-15 min) an epitalon intranasal infusion (20 ng) was made followed by up to 30 minutes activity recording. Few minutes after the infusion a significant activation of neural activity has been observed (2-2,5 times higher frequency of neural spikes). A complex response, consisting of several phases, has been identified in some recordings. The spikes frequency growth during 5 to 7 min (first phase) after the infusion was followed by the second (11-12 min) and the third (17-18 min) phases. An increase of neuronal spontaneous activity was conditioned by the higher frequency of already active units and by the involvement of previously silent cells. At least the first phase of epitalon action can be explained by direct action of peptide on the cells of motor cortex.
Keywords: Epitalon, motor cortex, microelectrode, intranasal infusion, peptide