Сибаров Д.А., Коваленко Р.И., Ноздрачев А.Д., Малинин В.В., Хавинсон В.Х.Влияние пептидов эпифиза на спонтанную электрическую активность пинеалоцитов крыс
ДАН, биол.науки, 2002, 385(4):568-570.
АННОТАЦИЯ
Обнаружено, что: интраназальные инфузии эпиталамина, эпиталона и окситоцина в дневное время подавляют процессы экзоцитоза в пинеалоцитах с низкой частотой электрической активности ; интраназальное введение эпиталона и его прямая аппликация на эпифиз вызывают одинаковый эффект при довольно низких концентрациях препаратов; 5-минутная задержка с момента инфузии до появл ения физиологического эффекта в эпифизе определяется временем транспорта веществ из носовой полости в эпифиз и ЦНС.
ВВЕДЕНИЕ
Известно, что пептиды эпифиза обладают иммуномодулирующими, стресс-протекторными, антиоксидантными и многими другими свойствами [1,4]. Наблюдаемые эффекты имеют централь ную и периферическую природу. При системном введении проникновению этих веществ в ЦНС в значительной степени препятствует гематоэнцефалический барьер. Неинвазивным способом доставки пептидных веществ в ЦНС являются интраназальные инфузии, при которых вещ ества могут: 1) связываться с рецепторами слизистой оболочки носовой полости и вызывать немедленные эффекты в ЦНС; 2) проникать в мозговой кровоток и попадать в ЦНС в районе циркумве нтрикулярных органов, к которым принадлежит и эпифиз; 3) захватываться окончаниями аксонов, приходящих из ЦНС в слизистую оболочку носа и попадать в мозговые структуры с аксональным транспортом; 4) диффундировать в ликвор через подпаутинное пространство обонятельных трактов [5]. Установлено, что частота деполяризации пинеалоцитов пропорциональна интенсивности выброса ими везикул с пептидным содерж имым [2, 6, 7], что позволяет судить об интенсивности секреторных процессов в пинеалоцитах. Для понимания механизмов саморегуляции эпифиза представляет несомненный интерес изучение возможности воздействия пептидных пре паратов эпифиза на секреторную активность самой железы. В связи с этим целью настоящей работы стало исследование влияния эпиталамина, эпиталона и окситоцина при интраназальном введении на спонтанную электрическую активность пинеалоцитов крыс.
МЕТОДЫ
У наркотизированных уретаном крыс-самцов Вистар (1.1 г/кг массы тела, внутрибрюшинно) удаляли фрагмент кости черепа диаметром 5 мм в области брегмы и перевязывали венозный синус для предотвращения кровотечения. Внеклеточная регистрация биопотенциалов проводилась при помощи стеклянного микроэлектрода, заполненного 3М NaCl (диаметр кончика 10-30 мкм, сопротивление 1-2 МОм). Сигнал с микроэлектрода усиливался в 100 раз, оцифровывался звуковой платой “Opti 931” под управлением программы “Cool-Edit Рro” (Syntrillium Inc., США), и обрабатывался разработанной нами программой (SMР v 5.0), определяющей частоты и характер разрядов отдельных клеток, а также проводящей их первичную статистическую обработку (P<0,05) [7]. Одновременно с микроэлектродной регистрацией крысам билатерально интраназально вводили растворы следующих пептидных препаратов: эпиталамин в дозе 10 мкг/крысу - 50 мкл (n=4), эпиталон в дозе 0.5 мкг/крысу - 50 мкл (n=8) и окситоцин в дозе 0.5 мкг/крысу - 50 мкл (n=3).
Эпиталамин - полипептидный препарат, выделенный методом уксуснокислой экстракции из эпиталамо-эпифизарной области головного мозга [1] (ООО “Самсон-Мед”, Санкт-Петербург).
Эпиталон - синтетический тетрапептид (Ala-Glu-Asр-Gly), сконструированный на основе анализа аминокислотного состава эпиталамина [3] в Санкт-Петербургском институте биорегуляции и геронтологии СЗО РАМ Н.
Окситоцин – H-Cys-Tyr-Ile-Gln-Asn-Cys-Pro-Leu-Gly-NH2 (Sigma).
В качестве контроля применяли физиологический раствор - 50 мкл (n=3).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Влияние эпиталона на электрическую активность пинеалоцитов изучали также в опытах in vitro (n=6). Эпифиз быстро (30 с) извлекали из тела наркотизированного уретаном живот ного и помещали в ванночку с аэрируемым физиологическим раствором при температуре 37oC. Эпиталон добавляли в ванночку с эпифизом в процессе опыта в количестве, достаточном для создания в инкубационной среде концентрации препарата 10-7 моль/л. Через 10-15 минут инкубационную среду в ванночке меняли, удаляя препарат и через 15 мин опыт повторяли. Регистрацию электрической активности пинеалоцитов проводили аналоги чно опытам in vivo.
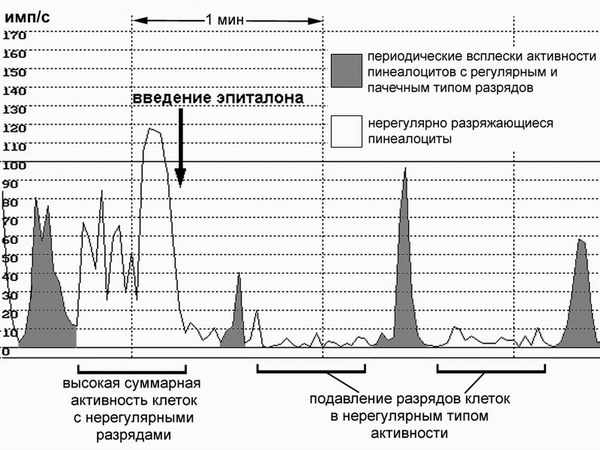
Интраназальное введение физиологического раствора in vivo вызывало немедленное кратковременное (1-1,5 минуты) неспецифическое усиление электрической активности эпифиза, о бусловленное его нервными связями с обонятельными структурами. Микроэлектродная регистрация разрядов пинеалоцитов выявила неравнозначное влияние интраназального введения эпиталона на пинеалоциты с различным типом активности. Начало действия эпиталона наб людалось через 6-8 минут после инфузии. Эпиталон снижал на 35-40% частоту редко разряжающихся клеток (0,05-0,01 имп/сек) с нерегулярным типом активности и в среднем на 25% частоту разрядов более часто разряжающихся кл еток (2,0-0,4 имп/сек) с регулярным типом активности (рис.1). Продолжительность эффектов варьировала, но в большинстве опытов составляла 3-4 мин. Интраназальное введение эпиталамина приводило к достоверному 30% снижению частоты разрядов всех типов пинеалоцитов через 5-8 минут после введения. Эффект был непродолжителен и через 20-25 минут после инфузии электрическая активность эпифиза возвращалась к исходным значениям. Интраназально е введение окситоцина оказывало небольшой (20-30%) подавляющий эффект на суммарную частоту разрядов пинеалоцитов, но этот эффект наблюдался только у части животных. Вероятно, временная задержка действия препаратов связана со временем их проникновения в м озговые структуры.
В опытах in vitro также наблюдалось неравнозначное действие эпиталона на пинеалоциты с различным типом активности. Добавление в ванночку с эпифизом эпиталона приво дило к 80-90% подавлению частоты разрядов клеток с нерегулярным типом активности, но не влияло на периодически разряжающиеся клетки с пачечными разрядами (рис.2).
Электрическая активность пинеалоцитов, регистрируемая в светлое время суток, по всей видимости, связана с продукцией железой веществ белково-пептидной природы [2, 6]. Мы полагаем, что задержка начала действия эпиталона при интраназальном введении определяется временем его транспорта из носовой полости в мозговые структуры. Кроме того, сходство эффектов эпиталона при интраназальном введении и при прямой аппликации на эпифиз in vitro позволяет предполагать, что при интраназальном введении препарат действительно достигает эпифиза и его эффекты не опосредованы через другие мозговые структуры. Чрезвычайно низкие физиологически активные концентрации эпиталона и идентичность его действия на эпифиз в опытах in vivo и in vitro позволяют предположить существование рецепторов к этому пептиду в самом эпифизе, однако этот вопрос нуждается в дальнейшей разработке. При интраназальном введении установлены специфические и неспецифические эффекты исследованных пептидов на эпифиз. Неспецифическое действие проявляется немедленно после введения препарата и обеспечивается нервными связями эпифиза с обонятельными структурами. Специфическое действие проявляется через 5-8 минут после инфузии и вызывается проникновением введенных веществ в эпифиз и другие структуры ЦНС. Влияния эпиталамина, эпиталона и окситоцина на электрическую активность железы было преимущественно тормозным и касалось толь ко популяции редко разряжающихся малоактивных пинеалоцитов, в которых, по-видимому, не происходит выброс секреторных гранул. Таким образом, некоторые вещества белково-пептидной природы, вырабатываемые эпифизом, помимо разнообразных гормональных эффектов в организме могут осуществлять регуляцию секреторных процессов в железе по механизму коротких отрицательных обратных связей в чрезвычайно низких физиологических концентрациях.
ЛИТЕРАТУРА
1. Морозов В.Г., Хавинсон В.Х. Пептидные биорегуляторы (25-летний опыт экспериментального и клинического изучения). СПб: Наука, 1996. 74 с.
2. Сибаров Д.А., Коваленко Р.И., Ноздрачев А.Д. // Росс. физиол. журн. 2000. Т. 86, №.8. С. 1049-1052.
3. Хавинсон В.Х. Тетрапептид, обладающий геропротекторной активностью, фармакологическое средство на его основе и способ его применения. Патент РФ № 2157233. 2000.
4. Хавинсон В.Х., Морозов В.Г. Пептиды эпифиза и тимуса в регуляции старения. СПб.: Фолиант, 2001. 160 с.
5. Chen X., Fawcett R.F., Rahman Y.-E. et al. // J. of Alzheimer’s Disease. 1998. N 1. P. 35-44.
6. McCance I., Parkington H.C., Coleman H.A. // J. Pineal Res. 1996. V. 21, N 2. P. 79-90.
7. Sibarov D.A., Kovalenko R.I., Anisimov V.N., Nozdrachev A.D. // Neuroendocr. Lett. 2000. N 21. P. 307-312.