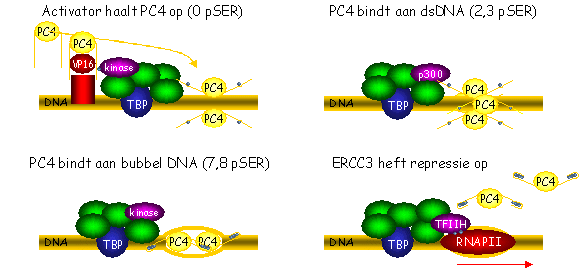
Samenvatting Proefschrift Henry Jonker: PC4 en VP16 Kennis op het moleculair niveau van gen expressie geeft ons inzicht in de samenhang tussen genotype en fenotype. Dit vereist onderzoek naar zowel biologisch functionele als structurele eigenschappen van vele factoren die betrokken zijn bij dit proces. Van specifiek belang is de nauwkeurige en specifieke regulering van RNA Polymerase II transcriptie. Transcriptie activatoren en cofactoren kunnen door aan bepaalde DNA gebieden en basale transcriptie factoren te binden, het transcriptie proces stimuleren of onderdrukken. Dit proefschrift beschrijft structurele biologie aan de algemene transcriptie cofactor PC4 en de activator VP16. Eerder onderzoek naar PC4 heeft aangetoond dat het uit twee domeinen bestaat. Het carboxy terminale deel van PC4 (PC4ctd) bindt met hoge affiniteit aan enkel-strengs DNA (ssDNA), bij voorkeur aan twee in tegengestelde richting lopende strengen zoals bij een DNA bubbel. PC4 stabiliseert het pre-initiatie complex (PIC), bindt vele transcriptie factoren en kan dubbel-strengs DNA (dsDNA) ontwinden. De dimeer structuur van PC4 was eerder opgehelderd met kristallografie en bestudeerd met NMR. Er was echter maar weinig bekend over het ongestructureerde amino terminale domein van PC4 (PC4ntd), dat betrokken is bij eiwit-eiwit interacties en bij binding aan dsDNA. Verder zijn activatie domeinen vaak ongestructureerd en was het veelal onbekend hoe zij interacteren met de andere eiwitten van het transcriptie apparaat. De doelstelling van dit onderzoek is om structurele en functionele informatie te verkrijgen over de interactie van PC4 met het activatie domein van VP16 (VP16ad), door gebruik te maken van hoge resolutie NMR spectroscopie en biochemische analyse. Bovendien is de fosforylatie van PC4 bestudeerd, waarvan voorheen is beschreven dat het de cofactor functie beïnvloedt. Een eerste NMR analyse van PC4 (Hoofdstuk 2) laat zien dat het interactie gebied voor VP16ad gedeeltelijk overlapt met dat voor ssDNA. Gerichte mutagenese bevestigt de bindingsplaats grotendeels en toont een kwantitatieve correlatie tussen PC4ntd residuen die de interactie met VP16ad stimuleren en de binding met ssDNA en DNA ontwinding negatief beïnvloeden. Biochemische experimenten laten zien dat VP16ad de DNA ontwinding blokkeert en tonen aan dat VP16ad en DNA competitief binden aan PC4. Opmerkelijk is dat PC4ctd wordt beïnvloed door de aanwezigheid van PC4ntd, hetgeen een regulerende rol voor PC4ntd suggereert. Dit domein kan de functionele gebieden van PC4ctd moduleren en/of afschermen en de bindingsaffiniteit aanpassen voor activatoren of ssDNA. PC4ntd bevat een gebied met veel serines en zure residuen (SEAC), een lysine rijk gedeelte en nog een serine rijk gedeelte. Onderzoek naar de structuur van PC4ntd laat zien dat dit domein extreem flexibel en voornamelijk ongestructureerd is, hoewel het lysine rijke deel en aangrenzende residuen neiging vertonen om secundaire structuurelementen te vormen. Deze eigenschap verandert nauwelijks door de interactie met VP16ad, wat aangeeft dat er geen rigide tertiaire structuur met PC4ntd wordt gevormd. Met NMR worden er echter wel veranderingen van chemical shift waarden waargenomen in het lysine rijke gedeelte en het SEAC gebied van PC4ntd, wat duidt op betrokkenheid bij de interactie. Aangezien de interactie voornamelijk elektrostatisch gedreven is, kan het lysine rijke gebied de aantrekking van VP16ad bevorderen door het aanbieden van een extra positief geladen oppervlak. Bovendien vermindert de flexibiliteit in het eerste a-helix gedeelte van het lysine rijke gebied enigszins, wat kan wijzen op stabilisatie van de PC4ctd-VP16ad interactie. NMR en biochemische data laten een regulerende rol voor PC4ntd zien door dynamische interacties met PC4ctd, activatoren en dsDNA om de activiteiten van PC4 te sturen. Het SEAC gebied van PC4ntd kan gefosforyleerd worden, wat belangrijke functionele gevolgen heeft. De wijze van fosforylering en de cruciale invloed op de cofactor functie van PC4 zijn in detail bestudeerd met behulp van biochemische analyse, MS en NMR (Hoofdstuk 3). De biochemische eigenschappen van PC4 worden in een duidelijke fosforylatie-status afhankelijke wijze beïnvloed. Eén fosfoserine is al genoeg om de affiniteit voor ssDNA binding te verhogen en dit verandert niet meer bij verdere fosforylatie. De aanwezigheid van meer dan één fosfoserine leidt tot een verlies aan VP16 binding en een vermindering van DNA ontwinding activiteit. De affiniteit voor dsDNA binding neemt geleidelijk af tot een minimum wanneer de fosforylatie volledig is. Als gevolg van fosforylering worden significante chemical shift veranderingen waargenomen in de b-sheet gebieden van PC4ctd. Deze worden zeer waarschijnlijk veroorzaakt door de veranderde omgeving vanwege de zwakke interacties tussen PC4ctd en PC4ntd. Analyse van MS en NMR data laat zien dat tot acht serines geleidelijk gefosforyleerd worden in de richting van de amino-terminus van het SEAC gebied, resulterend in graduele chemical shift veranderingen in de carboxy-terminale richting van het eerste deel van het lysine rijke gebied. Aangezien het getroffen gebied betrokken is bij de interactie met activatoren en DNA, wordt voorgesteld dat het functionele lysine rijke gebied gradueel wordt afgeschermd door het gefosforyleerde SEAC gebied, wat leidt tot gecoördineerde veranderingen in de cofactor functie van PC4. De regulerende fosforylatie correleert met de cofactor activiteiten van PC4 die worden uitgevoerd tijdens de transcriptie cyclus. Ten slotte zijn de eigenschappen van VP16ad bestudeerd (Hoofdstuk 4). NMR experimenten tonen aan dat twee gebieden, die betrokken zijn bij de interactie met PC4, een conformationele verandering ondergaan van ongestructureerd naar a-helix. Dezelfde gebieden worden op een vergelijkbare wijze beïnvloed door binding aan het carboxy-terminale domein van de algemene transcriptie factor TFIIB (TFIIBc). Biochemische experimenten tonen aan dat beide activatie subdomeinen nodig zijn voor coöperatieve interactie met PC4 en bevestigen het sterke elektrostatische karakter van de interactie. Modellen worden gepresenteerd voor de PC4ctd-VP16ad en TFIIBc-VP16ad complexen, gebaseerd op NMR chemical shift veranderingen en twee onafhankelijke docking methodes. Deze modellen zijn in overeenstemming met gerichte mutagenese resultaten. Dit onderzoek toont aan hoe de intrinsiek ongestructureerde domeinen van PC4 en VP16 betrokken zijn bij de regulering van RNA Polymerase II transcriptie. De uitermate flexibele PC4ntd is voornamelijk betrokken bij dynamische regulering van de cofactor functie van PC4, hetgeen gestuurd wordt door fosforylatie. VP16ad neemt structuur aan bij binding met diverse eiwitten en de docking modellen verklaren de hoge activiteit, coöperativiteit en de veelzijdige eigenschappen van dit transactivatie domein. De structurele en functionele studies aan PC4, VP16 en de fosforylatie van PC4 leiden tot een mogelijk model dat de verschillende cofactor activiteiten van PC4 in context van de transcriptie cyclus verklaart (Fig. 1). PC4 wordt eerst aangetrokken naar het promoter gebied door interacties met activatoren (VP16 Kd ~ 1 ÁM, Hoofdstuk 4). Fosforylatie van enkele serines door kinases in de PIC vermindert de affiniteit voor de activator. In deze fosforylerings tussentoestand bindt PC4 aan dsDNA (Kd ~100 nM, Hoofdstuk 3). Verdere fosforylatie zal de affiniteit voor dsDNA binding reduceren. PC4 kan, zeer waarschijnlijk samen met andere transcriptie factoren, DNA ontwinden en binden aan de DNA bubbel (Kd ~10 nM, Hoofdstuk 3) en zodoende het transcriptie proces stagneren. Als de samenstelling van het PIC klaar is, kan de ERCC3 component van TFIIH de repressie door PC4 opheffen en zodoende transcriptie starten. Verder verhindert PC4 de fosforylatie van RNA Polymerase II (RNAPII), een gebeurtenis waarvan over het algemeen wordt gedacht dat het een kritieke stap is van transcriptie initiatie naar elongatie. Aangezien gefosforyleerd PC4 niet langer in staat is om de fosforylatie van RNAPII te verhinderen, kan het transcriptie proces verder gaan in de elongatie fase van transcriptie.
 |