una corriente de vapor y su posterior condensación.

El vino contiene cierto numero de
ácidos orgánicos y minerales, que se encuentran al
estado libre o combinados, dando
origen a diversas sales.
Dentro del análisis de ácidos
de un vino, se pueden realzar las siguientes determinaciones :
- Determinar la acidez
total : Que es la suma de los ácidos libres sin tener en cuenta
su
naturaleza y que se mide por la
saturación de los ácidos libres por una solución alcalina
de
titulo conocido.
- Determinar la acidez
volátil : que es el conjunto de los ácidos grasos de
la serie acética
que son separados por destilación.
- Determinar la acidez
fija : que es la suma de los ácidos libres o acidez total menos
los
ácidos volátiles.
- Determinar la acidez
real o pH : que mide la concentración de iones H+, sin tener
en
cuenta la naturaleza ni la concentración
de los ácidos libres responsables de esos iones H+
- Determinar la cantidad total en
que se encuentra un ácido determinado en un
vino , sin
tener en cuenta los estados
en que e encuentra, ya sea como molécula entera, iones sales o
complejos.
Todos los ácidos que contiene
el vino son ácidos débiles, por lo que su neutralización
por
el hidróxido de sodio (o
de potasio según el caso) es progresiva y las variaciones de pH
no
tienen un punto de inflexión
marcado como en la titulación de un ácido fuerte con
una
base fuerte.
La acidez total del vino se expresa
en g/l de ácido sulfúrico, no existiendo limites en la
reglamentación alcohólica
chilena, por tanto el limite esta dado por el paladar ya que los
vinos de alta acidez constituyen
vinos verdes, duros; en cambio los de baja acidez son
neutros e insípidos.
Método :
Se utiliza fenoftaleina como indicador
(que vira a pH 8.5-9) por convención.
1- Con una pipeta se toman
10 cc de vino y se colocan en un vaso precipitado, si se desea
se puede diluir (vinos tintos)
y se agregan 2 ó 3 gotas de fenoftaleina al 1%.
2- Colocar en una bureta previamente ambientada NaOH o KOH N/10
3- Titular agitando constantemente;
a medida que la titulación avanza se produce un
cambio de color, debido a un cambio
en la estructura de las antocianas, produciéndose el
viraje a verde oliva en los
tintos, cambio que es mas notorio en los vinos nuevos
4- El fin de la titulación
esta marcado por la aparición de un color rosado, debido a la
fenoftaleina . Si el fin de la
titulación no esta claro, se puede verificar la reacción
mediante
papel tornasol
Cálculos :
cc de KOH N/10 Gastados * 0.0049*100
= g/l de acidez total en H2SO4
HOME
INICIO
La cantidad de anhídrido
sulfuroso que contiene un vino, hace variar considerablemente la
acidez volátil, ya que este
tiene la propiedad de ser fácilmente destilado y aumenta el
contenido de ácidos volátiles,
por lo que debe ser determinado en el mismo destilado para
descontarlo del resultado obtenido.
A continuacion se describen dos metodos, Duclaux Gayon
y Blarez
INICIO
HOME
cc KOH N/10 *50*1.23 +25% = g/l de acidez volátil aparente en ácido acético
Corrección del anhídrido sulfuroso
Como es necesario descontar el anhídrido
sulfuroso que ha pasado en el destilado, se
procede a titular sobre el mismo
destilado en que determino la acidez volátil aparente, el
anhídrido sulfuroso.
Titulación del SO2
1- al mismo destilado se le adicionan
4 ml de ácido sulfúrico al tercio y 2 ml de engrudo de
almidón como indicador
2- Colocar en una bureta previamente
ambientada I N/50 y titular hasta la aparición del
color azul morado, debido a la
primera gota de exceso de almidón que reacciona con el
almidón.
Calculo :
cc I N/50 * 0.00064 * 50 *1.88
= g/l de SO2 expresado como ac. Acético
Para obtener la acidez volátil
real, se le descuenta a la acidez volátil aparente el anhídrido
sulfuroso, expresado como ácido
acético:
(acidez volátil =
Ac. Volátil aparente - SO2 como ac. Acético)
Nota : En los vinos nuevos o con
alto contenido de CO2, este debe extraerse previo al
análisis mediante trompa
de vacío u otro método apropiado
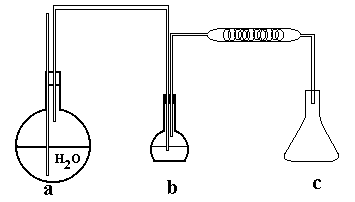
Este es el Método oficial
en Chile y esta basado en el arrastre de los ácidos volátiles
por
una corriente de vapor y su posterior
condensación.

1- Se toma con una pipeta de doble
aforo 10 cc de vino y se vierten el un matraz redondo
de capacidad de 200 ml (matraz
B)
2- Se cierra dicho matraz con un
tapón de caucho provisto de 2 orificios, por un de los
cuales pasa un tubo de vidrio que
llega casi hasta el fondo del matraz y cuyo otro extremo
doblada en ángulo se une
mediante un tubito de goma o la válvula D a otro tubo de vidrio
acodado que penetra en un matraz
redondo de un litro de capacidad (matraz A) y en este
ultimo se vierte agua destilada
débilmente neutralizada para eliminar el CO2 que pueda
contener. Por el segundo de los
orificios del tapón matraz que contiene el vino, sale otro
tubo de vidrio que se une al refrigerante
. El matraz que contiene el agua destilada lleva un
tubo de seguridad
3- A la salida del refrigerante
se coloca un matraz de 500 ml de capacidad aforado a 200
ml
4 -Se calienta el matraz A hasta
la ebullición y cuando el volumen del matraz B este con los
10 ml ,se calienta suavemente el
matraz B, de manera que la llama mantenga siempre
constante el volumen del liquido
.
5- Cuando en el matraz C se hayan
recogido cerca de 200 ml, se da por terminada la
operación
6- La titulación se efectúa mediante una solución de KOH N/10
7- Calculo :
cc KOH N/10 *0.0049 *100*1.023
= g/l Ac. Volátil aparente en Ac. Acético
Titulación del SO2
1- Al mismo destilado se le adicionan
10 ml de ac. sulfúrico al tercio y 2 ml de engrudo de
almidón como indicador
2- Como en el caso anterior, se procede titular con I N/50
Calculo :
cc I N/50 * 0.00064 * 100 *1.88
= g/l de SO2 expresado como ac. Acético
Determinación de la acidez real o pH
EL pH mide la concentración de iones H+, que en el caso d los vino fluctúa entre 2.9 y 3.9
Uso del potenciometro :
1- colocar en un vaso de precipitado
la solución tampón de que se disponga para efectuar
el ajuste. Ideal es utilizar un
tampón cercano al rango de mediciones
2- Ajustar el aparato al pH indicado
por el tampón, desconectarlo, retirar los electrodos y
lavarlos con agua destilada
3- Colocar el vino en un vaso de
precipitado y efectuar la determinación
Nota : el potenciometro nunca debe
conectarse a la posición de lectura si los electrodos no
están sumergidos en el liquido
Determinación de los ácidos Tartarico, Malico, láctico
La cromatografía sobre papel
permite separar los ácidos orgánicos que se encuentran en
el
vino y por comparación con
soluciones testigo de los diversos ácidos, se puede apreciar la
cantidad de ácido que contiene
el vino.
Manipulación :
1- A 3 cm del borde inferior de
un rectángulo de 19 * 45 cm de papel Wathman N°1, se
traza una línea con lápiz
de grafito, sobre la cual serán dispuestas, cada 2.5 cm las gotas
de vino a estudiar y las de soluciones
testigo con la ayuda de una micropipeta
2- Con la micropipeta, que ha sido
lavada previamente en alcohol al 50% se procede a
colocar 2 mm3 de cada solución
testigo (ej. Ac. Málico a 1 g/l, 2g/l, 3g/l) y de los vinos
a
analiza. Luego se procede a secar
el papel con ayuda de un secador
3- Una vez seco el papel se coloca
en la cubeta que contiene el solvente, mojando en el
solo el borde inferior de la hoja
y se cierra esta en forma hermética
4- una vez que el frente del solvente
ha llegado a 2 o 3 cm del borde superior de la hoja, se
retira el cromatograma y se seca
en una corriente de aire frío
5- Los ácidos del vino se
separan en el siguiente orden : en la parte mas baja el ácido
tartarico, al centro el ácido
Málico y en la parte superior los ácidos láctico y
succínico
6- El solvente revelador colocado
en la cubeta esta formado por : Butanol (puro normal)
que contiene 1g/l de azul de bromofenol
(40ml) y por 20 ml de ácido acético al 1/2 (10 ml
ac. acético puro por 10
ml de agua destilada)
Resultados :
Se compara el tamaño e intensidad
de las manchas de color amarillo de las soluciones
testigo con las de los vinos a
analizar (las manchas a la misma altura corresponden a un
mismo ácido)
Si un vino no contiene ácido
Málico, significa que ya ha sufrido la fermentación
maloláctica
El gas sulfuroso o anhídrido
sulfuroso ha sido utilizado desde tiempos remotos en la forma de mechas,
para la conservación de
fudres de madera y voluntariamente agregado al vino, para protegerlo de
las
alteraciones microbianas por su
poder antiséptico y por su efecto antioxidante ( es el único
tolerado por
nuestra ley)
El gas sulfuroso agregado al vino
se combina en algunas horas o días con el aldehído,
azucares,
polifenoles y particularmente a
las materias colorantes, pero si la cantidad agregada es suficiente, una
fracción permanece en estado
libre
En un vino dado existe un equilibrio
entre el sulfuroso libre y el combinado, de tal manera que todo
aumento (por adición) o
toda disminución (por oxidación) del libre, efectúa
una variación en el mismo
sentido del sulfuroso combinado
Principio de la determinación
La determinación es una aplicación
de la yodometría. Se sabe que el yodo en presencia de ácido
y
agua tiene propiedades oxidasteis,
de acuerdo a la siguiente ecuación :
I2 + H2O ---------------> 2HI + O
El sulfuroso es un cuerpo fácilmente oxidable y pasa al estado de ácido sulfúrico
SO2 + O -------------------------->
SO3
SO3 + H2O ---------------------->
H2SO4
SO2 +2H2O + I2 ---------------->H2SO4
+ 2HI
Esta es una reacción cuantitativa,
bastara conocer entonces el titulo de la solución de yodo, para
saber
el contenido de sulfuroso que existe
en determinado volumen de vino. El exceso de yodo que no
reacciona se hará presente
por el engrudo de almidón que sirve de indicador.
De las ecuaciones anteriores se
desprende que 127 gr. de I oxidan 32 gramos de anhídrido sulfuroso,
luego 1 cc de una solución
de yodo podrá oxidar 0.00064 de anhídrido sulfuroso, siendo
este el titulo
que mas se usa en laboratorio.
Las tolerancias en distintos vinos
es como sigue
Sulfuroso libre
Sulfuroso total
Vino seco 75 mg/lt
100 mg/lt
Vino dulce 100 mg/lt
400 mg /lt
La finalidad del ácido sulfúrico
es doble, por una parte acidificar mas el medio para obtener un viraje
mas nítido y por otra desplazar
el sulfuroso libre.
Método rippert para el sulfuroso
total ( Vinos blancos )
Esta determinación es igual
a la anterior, pero se necesita agregar al vino una solución de
potasa
(KOH) 1N, cuyo objetivo es apoderarse
del sulfuroso combinado, con formación de bisulfito de potasio
que es fácilmente descompuesto
por el ácido sulfúrico.
Para la dosificación y cálculos se procede igual que en el caso anterior.
Método : Se toman 50 cc de
vino en un matraz, se agregan 25 cc de KOH 1N (56 g/l) se tapa bien
y se
agita dejándolo en reposo
por 15 minutos aprox., al cabo de los cuales se acidifica con 10 cc de
ácido
sulfúrico al 1/3, se agrega
solución de almidón y se deja caer el yodo N/50, hasta coloración
azul . Los
cc de yodo gastados se multiplican
por el factor 0.0128 y se obtienen los g/l de SO2
Descuento del anhídrido sulfuroso de la acidez volátil aparente :
Se puede realizar como se señalo
en el punto ..... o bien, se puede prescindir del destilado en cuestión.
Para ello, se determina el sulfuroso
total y el libre y se aplica la siguiente formula :
Ac. Volátil = Ac.
volátil aparente - (SO2 libre + 1/2 SO2 combinado)*1.88
Donde SO2 combinado = SO2 total
- SO2 combinado
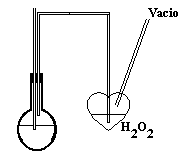
Método de Burroughs-Sparks o del corazón
Este método se utiliza en
los vinos blancos jóvenes que tienen un alto contenido de CO2, ya
que este
enmascara en parte al SO2 cuando
se determina este ultimo mediante el método de rippert.
Método :
Se toman 20 ml de vino en un matraz
esférico especial para el método y se agregan 5 ml de ácido
ortofosforico al 25%. Luego en
el corazón se introducen 5 ml de agua oxigenada .
Se conecta el matraz esférico
al corazón en cuyo tapón se dispone de 2 tubos de vidrio,
uno que llega
hasta el fondo del corazón
y el otro sobre el nivel de liquido, el primero es el que se conecta al
matraz
esférico, el segundo va
a una bomba de vacío.
Se hace burbujear mediante el vacío
formado y 10 minutos mas tarde se retira el corazón y se vacía
su
contenido en un vaso de precipitado,
este se titula con NaOH 0.01N hasta que el azul inicial vire a un
color verde claro. El gasto se
multiplica por 16 y se obtienen g/l de SO2 libre
El peso específico o densidad indica la relación entre la masa de cierto volumen de este vino y la masa de un mismo volumen de agua a 4ºC. La densidad del agua varía de acuerdo a la temperatura, a la concentración de azúcares o sólidos en el mosto y al grado alcohólico. Dado que la densidad del alcohol es 0,79 y la del agua 1,0 y como el vino es una mezcla hidroalcohólica se deduce entonces que a mayor contenido de alcohol menor sea la densidad y viceversa.
Este análisis se justifica en la determinación de madurez en el jugo de las uvas a cosecha,. donde por medio de conocer la densidad de ese jugo o mosto se puede estimar el grado alcohol potencial que puede obtenerse después de la fermentación. Sin embargo en el vino tiene una importancia secundaria puesto que sí bien nos permite observar si el vino ha tenido una fermentación completa, esto lo indica con mayor precisión la determinación de azucares reductores.
Procedimiento
En uvas se obtiene el mosto o jugo por presión el que se agrega a una probeta de 250 ml, previamente enjuagada con el jugo muestra, en esta probeta se pone el densímetro dándole un ligero movimiento giratorio esperando a que estabilice para leer por debajo del menisco, anotando hasta la décima. Esta lectura se debe corregir según la temperatura de la muestra, para ello se deberá tomar la temperatura del líquido después del densímetro, dependiendo de la calibración del instrumento 15ºC o 20ºC se utilizan diferentes tablas de corrección que vienen incluidas con el instrumento. La densidad normal en mostos se encuentra en 1100 a 1040 dependiendo de la madurez de la uva, entendiendo que mayor madurez más azucares y por ende mayor densidad.
Durante el proceso de fermentación esta densidad comienza a bajar hasta llegar, en el vino, cercano a los 990-992. Se considera vino seco o fermentación completa cuando la densidad alcanza en los tintos alrededor de 994 g/l y en los blancos 990-992 g/l.
Es el peso del residuo fijo contenido después de la evaporación de las sustancias volátiles. Está constituido en su mayor parte por los ácidos fijos y sus sales, azúcares, materias minerales, glicerol, compuestos fenólicos, materias pécticas, sustancias nitrogenadas, etc. El extracto seco de los vinos blancos varía entre 20 y 25 g/l y en los tintos de 25 a 30 g/l. Los vinos prensas tiene siempre un mayor contenido en extracto seco que los vinos gota de los cuales provienen.
La evaporación de estas sustancias se efectúa generalmente a baño-maría a 100ºC. Sin embargo, este método de determinación es objeto de numerosas críticas, ya que puede disminuir exageradamente el volumen de la muestra lo cual erra la determinación.
El extracto seco reducido (E.S.R.) corresponde al extracto seco disminuido de los azucares que exceden 1 g/l, de los sulfatos que exceden 2 g/l, de los cloruros que exceden 0,5 g/l y de toda sustancia química eventualmente agregada al vino.
Este dosaje presenta una gran importancia desde el punto de vista comercial como químico. Es útil cuando se buscan pruebas de un "aguado" o de una adición de azúcar. En esos casos se puede considerar el valor de la relación: peso del alcohol total / E.S.R. = por litro, o como se le denomina corrientemente, relación alcohol extracto seco reducido.
Como todos los jugos vegetales, el mosto contiene un gran número de materias minerales. El vino que resulta de su fermentación es siempre menos rico en elementos minerales y en ciertos casos pueden desaparecer. Se denomina cenizas del vino al residuo de calcinación de extracto seco, completamente desprovisto de carbón. De otra manera, se denomina cenizas al conjunto de los productos de la incineración del residuo de la evaporación del vino, conducido de manera de obtener la totalidad de los cationes (amonio excluido) bajo la forma de carbonatos y otras sales minerales anhídras.
Los vinos tintos tienen mayor contenido de cenizas que los blancos. Las cenizas o materiales minerales contenidas en un vino oscilan entre 1 y 3 g/l, y supone aproximadamente el 10% del extracto seco.
La determinación de las sustancias minerales contenidas en el vino, cenizas, sirve, entre otras cosas, para diagnosticar si un vino ha sido aguado.
Otro análisis que se puede realizar además a las cenizas es su alcalinidad. Las cenizas del vino son alcalinas, en efecto, en el momento de la calcinación, los ácidos orgánicos libres desaparecen completamente o bien son transformados en carbonatos, especialmente los ácidos tártrico y málico, así como el bitartrato de potasio y el tartrato neutro de calcio, dando carbonatos alcalinos o alcalino térreos, de reacción alcalina. En cuanto a los ácidos minerales fuertes, que están en el vino al estado de sales, ellos se encuentran bajo el mismo estado en las cenizas.
Por lo tanto, la alcalinidad de las cenizas mide la cantidad de ácidos orgánicos que están en el vino bajo la forma de sales más o menos disociadas, estos valores de alcalinidad de las cenizas pueden representar un índice de seguridad en el aguado o en confirmar la adición de ácido sulfúrico a ciertas muestras, para aumentar color en tintos o subir la acidez total en vinos blancos.
Este tipo de análisis se deberá encargar a laboratorio especializado.
En los vinos bien constituidos, se constata siempre la presencia de una pequeña cantidad de cloruros minerales, especialmente de sodio y de potasio. Estas sales contribuyen a darle el sabor sápido a los vinos.
Se puede dosar separadamente los diversos cloruros, pero se acostumbra a hacerlo en conjunto y expresar el resultado en cloruro de sodio (gramos /litro). El contenido de cloruros en los vinos es variable, en general es inferior a 0,5 g/l, expresado en cloruro de sodio limite máximo por Ley, y excepcionalmente puede pasar de 1 g/l, sobre todo en viñedos ubicados en terrenos salinos o cerca del mar. Un aumento de los cloruros puede deberse también a la utilización de NaCl en el encolado de los vinos o por adición de ácido clorhídrico, lo cual está rigurosamente prohibido.
Para la determinación puede operarse directamente con las cenizas del vino, que contienen los sulfatos y los cloruros, aunque siempre se prefiere actuar sobre el vino directamente.
El vino contiene al estado natural una pequeña cantidad de sulfatos, los cuales provienen del racimo (0,1-0,4 g/l de sulfato de potasio). Esta cantidad aumenta durante el envejecimiento debido al sulfitaje de los vinos, mechado de los fudres y aireaciones sucesivas a partir de una pequeña dosis que la planta extrae por las raíces del suelo. La cantidad es del orden de 0,6-0,7 g/l, expresado en K2SO4, en vinos normales, y puede llegar a 2 g/l en vinos envejecidos o vinos licorosos. La legislación chilena permite un máximo de 2 g/l y 6 g/l de K2SO4 en vinos secos y dulces, respectivamente. En vinos normales, no envejecidos, si la concentración pasa de 1 g/l, se puede suponer la adición de yeso o de ácido sulfúrico, para aumentar color en tintos, esto se confirma al encontrarse un pH muy bajo, una alcalinidad de cenizas baja en relación al peso de ellas y un contenido alto de sulfatos.
El mosto contiene varias decenas de miligramos de amonio. Después de la fermentación disminuye a casi cero, pero en el caso de los tintos vuelve a aumentar si ocurre la fermentación maloláctica (a aproximadamente 100 mg/l). En el caso del nitrógeno total se deberá recurrir a su medición por el método Kjeldahl. Los mostos y vinos contienen sustancias nitrogenadas las cuales constituyen una parte importante del E.S. (alrededor del 20%); estas sustancias se encuentran como proteínas, peptonas, polipéptidos y aminoácidos.
El contenido de calcio en los vinos blancos oscila entre 80 y 140 mg/l; los vinos tintos contienen un poco menos. El límite de la concentración en los vinos está fijado por el producto de la solubilidad del tartrato neutro de calcio. El calcio juega un rol importante en los vinos, pudiéndose producir una precipitación lenta de tartrato de calcio cuando éste está en exceso. Igualmente participa en la precipitación de los coloides, en especial del enturbiamiento férrico y del coloide formado por acción del tanino sobre la gelatina en la clarificación de los vinos.
En el vino como en todos los vegetales, el potasio predomina siempre entre los demás cationes. Se requiere conocer este elemento en los procesos modernos de elaboración para prevenir la precipitación del tartrato ácido de potasio. Conociendo el contenido de potasio y ácido tártrico (la determinación de ácido tartárico se tratará más adelante) es posible predecir el potencial de estabilidad o inestabilidad del tartrato ácido de potasio en el vino. Esto es particularmente importante en los países donde usan intercambio catiónico para reducir el contenido de potasio en los vinos.
El contenido de potasio del mosto depende de la variedad de uvas, condiciones climáticas en que crecen las plantas, tiempo de cosecha y de otras variables tales como : temperatura de fermentación y guarda, tiempo de almacenaje, ph, porcentaje de alcohol, uso de resinas de intercambio, filtros, clarificaciones.
Método :
La potasa está conformada por las sales de potasio que contiene el vino, las cuales se precipitan con ácido tártrico incluyendo parte de los sulfatos.
Para ello se procede en igual forma que en la determinación de ácido tártrico, pero agregando esta vez 1 ml de solución alcohólica de 30º de ácido tártrico al 10% en lugar de bromuro de potasio.
La potasa total se expresa también en tartrato ácido de potasio para lo cual el cálculo se hace en forma idéntica al señalado para el ácido tártrico, mencionado más adelante.
El mosto contiene cobre que se insolubiliza casi en su totalidad en la fermentación alcohólica. Posteriormente, puede enriquecerse por contacto material vínico, en especial con la broncería. Un método rápido y preciso es a través de espectrofotometría, sin embargo esta técnica requiere de un laboratorio especializado.
El vino contiene siempre fierro: 2-5 mg/l que provienen de las uvas; el excedente proviene de la tierra, del material de vinificación, de cubas de cemento mal revestidas o sin revestimiento, etc. El fierro se encuentra en el vino bajo diversos estados: al abrigo del aire (ambiente reductor), el fierro se encuentra al estado ferroso (Fe+2) totalmente soluble, pero si el vino sufre una aireación el fierro pasa al estado férrico (Fe+3), forma bajo la cual puede precipitar con los fosfatos, esto es especial en vinos blancos, esta precipitación se denomina Casse o enturbiamiento blanco o fosfato-férrica. En los vinos tintos ocurre con los taninos donde se denomina tanato-férrica.
Un enturbiamiento férrico puede aparecer desde unos 10 mg/l en los vinos blancos y unos 20 mg/l en los vinos tintos. Sin embargo el enturbiamiento puede ocurrir a niveles más bajos.
El fierro forma sales coloreadas con numerosos reactivos, por lo que existen numerosas determinaciones colorimétricas, en particular con el sulfocianuro de potasio y la ortofenantrolina, sin embargo este tipo de análisis requiere de equipos especializados, por lo tanto para ello se deberá encargar a laboratorio especializado.
Sin embargo, a nivel de bodega se puede realizar la determinación de fierro total (Fe+2 más Fe+3) y para ello se utiliza el que se denomina ferrómetro Hubert y una solución de ferrocianuro de potasio (sol. al 10%).
Al ferrómetro Hubert se le adicionan 50 ml de vino filtrado, al cual se le agregan 10 gotas de la solución de ferrocianuro, se agita y se deja quieto por 24 horas. Se formará un precipitado azul, que se conoce como azul de Prusia. El mismo ferrómetro se encuentra graduado de 1 a 5 donde cada grado Hubert corresponde a 12 mg/l de fierro total.
Como se mencionó anteriormente, si los niveles de fierro son excedidos se crean serias posibilidades de enturbiamientos, para evitar esto se realizan tratamientos en base a adición de ferrocianuro de potasio, quién hace precipitar el fierro formando azul de Prusia. Este tratamiento requiere de un alto grado de conocimiento y precisión, ya que excederse en los niveles de ferrocianuro de potasio crea en presencia de anhídrido sulfuroso ácido cianhídrico el cual es altamente tóxico al humano, es por ello que la Ley suscribe a un Enólogo como único autorizado para estar a cargo del tratamiento (este punto se tratará en Tratamiento de Ferrocianuro).
Cuando el vino se encuentra bien fermentado (seco), no deben encontrarse sino pequeñas cantidades de materias reductoras, constituidas en su mayor parte por azúcares que se han escapado de la fermentación del mosto primitivo.
Debe considerarse como una proporción normal de azúcares fementescibles en los vinos 2 gramos por litro. Los vinos que tienen tres a cinco gramos por litro poseen un gusto azucarado, considerado un defecto grave. Los azúcares permiten el desarrollo de un número de microorganismos patógenos, especialmente de bacterias, capaces de transformarlos en ácidos, propiónicos, butírico y fórmico los que en cantidades mínimas pueden despreciar los mejores productos.
El azúcar contenido en el mosto, no es la sustancia comúnmente llamada sacarosa, que produce la caña de azúcar, sino otra sustancia sacarina constituida por una parte sólida cristalina denominada glucosa (dextrosa) y una no cristalizable denominada levulosa. Ambos azúcares tienen la misma composición química : C6 H12 O6 y se diferencian entre sí por el modo de comportarse con la luz polarizada.
La cantidad de cada una de ellas, varía según el estado de madurez de la uva. En un mosto de uvas en plena madurez, la dextrosa está casi en cantidad igual a la levulosa ; en la uva no enteramente madura predomina la dextrosa, y en la madura la levulosa.
Una de las propiedades en que se diferencia el azúcar de uva de la sacarosa, es que ésta no ejerce sobre las soluciones de algunos óxidos metálicos ricos en oxígeno, ninguna acción reductora ; mientras que el azúcar de uva, como cada uno de sus componentes, obra sobre esas soluciones como verdadero reductor, transformando los óxidos metálicos en sub-óxidos y a veces dejando el metal completamente en estado libre. Esta reacción se verifica, siempre de acuerdo con una relación fija entre el óxido reducido y el azúcar reductor. Puede calcularse por lo tanto, la cantidad de azúcar que se gasta para reducir un óxido, pesando el sub-óxido formado.
Entre las soluciones de óxidos metálicos capaces de ser reducidos por el azúcar de uva se ha elegido el óxido de cobre, porque el punto que señala la completa reducción puede ser bien definido.
Haciendo pues obrar en caliente, sobre una solución alcalina de una sal cúprica, una solución de azúcar de uva, el óxido cúprico que da a la solución un color azul intenso se reduce transformándose en óxido cuproso, polvo insoluble de color rojo fijo ladrillo.
La solución adoptada como método oficial para el dosaje de los azúcares, es la debida a Fheling que se prepara de modo que el óxido cúprico contenido en 20 cc de licor de Fheling sea reducido por 0.050 grs. de glucosa pura.
Para conservar una solución indefinida de este licor es conveniente prepararlo en dos soluciones que se guardan separadamente y se mezclan en partes iguales en el momento de operar.
SOLUCION "A" Cúprica
Sulfato de cobre cristalizado, CuSO4 40 grs en agua destilada completando a
1000 cc.
SOLUCION"B" Tartrato alcalino
Tartrato doble de Na y K (sal de seignette) 200 grs.
Soda cáustica en placas
Agua destilada completar a 1000 cc
Procedimiento
1.En un matraz de doble enrase (100-110) se mide 100 cc de vino y se le agregan 5 cc de sub-acetato de plomo al 15% para precipitar materias que no son azúcares y que tienen sin embargo, un pequeño poder reductor.
2.En seguida se tapa el matraz con el dedo y se agita suavemente, se vacía a un matraz Erlenmeyer, en el cual se ha puesto más o menos 2 a 3 grs. de carbón animal con el fin de decolorar la solución (a los vinos blancos se les pone menor cantidad que a los tintos).
3.Después de dejar en reposo por unas dos horas se agregan 5 cc de solución al 15% de Na2SO4, para neutralizar el exceso de sub-acetato de plomo y se procede a su filtración lo que se hace en un papel con pliegues. Después de este tiempo la solución se echa a una bureta graduada, quedando lista para la titulación.
4.Por otro lado, en un matraz de 200 cc se vierten 10 cc de solución "A" y 10 cc de solución "B" se agregan 40 cc de agua destilada, pedacitos de piedra pómez y se hace hervir la mezcla, y sobre ella se hace caer gota a gota el líquido de la bureta hasta la decoloración completa y que el tono del líquido, en el que sobrenada el precipitado rojo que se forma, sea ligeramente amarillento y desprovisto de tono verdoso, (agréguese piedra pómez y 40 cc de agua destilada antes de hervir).
A fin de acentuar aún más el viraje agregarse 1 o 2 gotas de azul de metileno al 1% al momento de empezar a desaparecer en color azulado.
Para determinar la cantidad de glucosa que contiene la muestra hay que tener presente que los n cc gastados en la reducción del licor contienen 0.050 grs.
n cc. Contienen 0.05 grs.
1000 cc " X
X = 50 / n
Como al defecar por medio del sub-acetato se ha diluido en 10% la cantidad verdadera de glucosa, que contienen la muestra (5 cc + 5 cc) es necesario agregar al resultado la décima parte, por lo cual la fórmula se transforma en :
GLUCOSA POR LITRO: 1.1 x 50 = 55 / n
Nota : Este procedimiento exige cierto hábito y una práctica continua, por lo cual los principiantes fracasan frecuentemente de ahí que sea necesario hacer dos titulaciones (la última de confirmación).
Este análisis es de rigor para vinos que estén terminando su fermentación, un nivel de densidad 992 a 994 no asegura la sequedad del vino si el dosaje de materias reductoras bajo los 2 gramos por litro.
La determinación del azúcar de caña sólo se realiza en vino secos cuando, en ensayos de polarización, se constata la presencia de sustancias dextrógiras extrañas, en cantidad apreciable ( de 0.3º a 0.6º)
Cuando se trata de averiguar si un vino contiene azúcar de caña, debe hacerse enseguida el ensayo a su presencia. En el caso de los vinos secos, debe detenerse al proceso de su inversión, neutralizando exactamente el vino y luego colocándolo a unos 80º C de temperatura en un frasco lleno hasta ¾ partes , bien tapado, en baño de agua, durante 15 minutos. Para los cálculos posteriores se deberá tomar en cuenta el aumento de volumen correspondiente a la adición de lejía que se emplea en la neutralización.
Determinación :
1.Del vino decolorado, por el sistema ya estudiado en la determinación de las materias reductoras, se colocan 50 cc en un matraz de 100 cc y se procede a afectuar el proceso de inversión de la sacarosa, en glucosa y levulosa, con 1 cc de ácido clorhídrico puro.
2.Se coloca el matraz en baño maría durante una hora y a 70ºC de temperatura. Una vez frío, se neutraliza el vino con soda al tercio, o más concentrada. Se constata la neutralización, agregando un trozo de papel tornasol que recupera su color azul en el punto neutro. Una vez conseguido esto, se completa volumen a 100 cc con agua destilada.
3.En estas condiciones proceda a la determinación de las materias reductoras por cualquiera de los procedimientos estudiados.
4.De los cc de vinos gastados se debe considerar sólo la mitad por la dilución efectuada con la soda, ácido clorhídrico puro y el agua destilada. Para ello se dividen los cc de vino gastados por dos y se calcula a cuantos gramos de materias reductoras corresponde.
5.A estos gramos se le restan los equivalentes de la materia reductora sin inversión, o sea, las materias reductoras naturales del vino y la diferencia, expresada en glucosa, se multiplica por 0.95, para obtenerla expresada en sacarosa en gramos por litro.
Este análisis se deberá encargar a laboratorio que posea la tecnología para realizarlo.
HOME
INICIO
. Alcohol
Etílico (CH3 CH2 OH).
La proporción de alcohol que contiene un vino, se expresa en grados alcohólicos según el principio de Gay-Lussac. El alcohol puro tiene un título igual a 100 grados y el grado alcohólico es igual al número de litros de alcohol etílico que contiene : 100 litros de vino, siendo los dos volúmenes medidos a la temperatura de 15ºC ; por lo tanto, 1 grado alcohólico corresponderá a 1 ml de alcohol puro contenido por cada 100 ml de vino.
Los resultados analíticos de los principales constituyentes del vino se expresan siempre en gramos por litro. El grado alcohólico es una proporción o porcentaje en volumen. Es posible expresarlo también en gramos por litro, multiplicando por 10 y por la densidad relativa del alcohol que es 0.79433 a 15ºC. En la práctica se toma el coeficiente 8.
El contenido en alcohol de los vinos naturales, cuando el contenido en azúcares del mosto lo permite, puede llegar hasta 16º o un poco más, ya que la levadura tiene un límite de resistencia al alcohol. En el laboratorio algunas cepas de Saccharomyces oviformis pueden fermentar hasta 18º del alcohol.
Importancia del Grado Alcohólico:
- Es la base para las transacciones comerciales en los vinos corrientes.
- Nos indica si el vino está dentro o fuera de la ley.
- Interviene en la corrección de la densidad, en el cálculo de relación alcohol-extracto seco reducido y en el de la suma alcohol-ácido.
Es importante recordar que durante el envejecimiento del vino en fudres, el grado alcohólico disminuye por evaporación en 0,2 a 0,5º en un año,
A) Métodos de determinación:
La determinación del grado alcohólico del vino, es el análisis más corriente y más importante por las razones antes dichas, pero es también una de las más delicadas, que requiere precauciones minuciosas, ya que se tiene el hábito de exigir una precisión a la que se llega difícilmente ; determinar con una décima de grado el contenido en alcohol de un vino, que tenga por ejemplo 12º, es pedir una precisión superior al 1%.
Determinar la décima de grado no significa garantizar la exactitud de ella, si no de que el error en la expresión de las décimas no pasará de uno. La especificidad misma de la determinación del alcohol alcanza 0,5 a 1,0 % y es necesario no olvidar que en el grado alcohólico se expresa un conjunto de diversos cuerpos (alcoholes etílicos, metílicos, isobutílicos, isoamílico, propílico, amílico, etc), por lo tanto el destilado debe ser considerado como una solución de agua y etanol, con una aproximación de 0.5 a 1.0%.
En general, los métodos más utilizados se pueden dividir en 3 grupos.
- Métodos químicos por oxidación crómica.
- Métodos que separan el alcohol por destilación.
- Métodos ebullométricos.
En este texto se verán solamente los métodos por destilación y los ebullométricos.
A.1.) Métodos que separan el alcohol por destilación.
El alcohol etílico o etanol es un cuerpo que se evapora y condensa con facilidad, propiedad que se aprovecha para separarlo de los otros elementos del vino por ebullición y condensación.
Los métodos oficiales de determinación del alcohol, en uso en todos los países vinícolas, están basados en al diferencia de la densidad del agua y del alcohol que es bastante grande. La densidad relativa del alcohol puro a una temperatura de 15ºC es de 0.79433, por lo tanto, a medida que el grado alcohólico se eleva en una solución, el peso específico de ella disminuye.
La densidad de las soluciones hidroalcohólicas se determinan por medio de la picnometría (oficial en Alemania), procedimiento ponderal que es el más riguroso, también se puede determinar con la balanza hidrostática de Mohr y Wesphal y, sobre todo, por aerometría, empleando un alcohómetro centesimal de Gay-Lussac controlado (método oficial en Chile).
Pero para que la densidad obtenida con estos métodos tenga un valor que indique el grado alcohólico, es necesario trabajar sobre un líquido que esté privado, en la forma más completa posible, de elementos extraños. Para lo que se somete el vino a una destilación, en las condiciones convenientes y es la densidad del destilado la que se determinará con precisión.
A.1.1.) Aparatos de destilación :
El aparato de destilación más simple está constituido por un matraz de vidrio de 500 ml que sirve de caldera, ligado a un largo condensador de vidrio en forma de serpentín, por un tubo de vidrio con tapones de goma o mejor aún por tubos de vidrio con las puntas esmeriladas.
Los aparatos metálicos, llamados alambiques, no deben ser utilizados ya que no permiten vigilar la destilación y pueden tener fisuras o picaduras que la mayoría de las veces son invisibles. Los aparatos de miniatura, que trabajan con pequeños volúmenes de vino, dan resultados con escaso valor por lo que no deben emplearse.
Determinación
1.Se miden 200 ml de vino en un matraz aforado, que ha sido previamente ambientado y se procede a tomar la temperatura a la cual fue aforado.
2.En un matraz de 500 ml se introducen los 200 ml de vino y se enjuaga 2 ó 3 veces el matraz de 200 ml con agua destilada, utilizando para esto un volumen total de alrededor de 50 ml de agua, que se introducen también en el matraz de 500 ml.
3.Se procede a neutralizar el vino con KOH o NaOH concentrado hasta ambiente alcalino, lo que se determina por el cambio de color que sufre el vino o por medio del papel tornasol. Es indispensable neutralizar el vino antes de la destilación, para evitar el paso de los ácidos volátiles al destilado : ácido carbónico, ácido acético y anhídrido sulfuroso. La presencia de estos ácidos en el destilado produce un aumento de la densidad , lo que se traduce en una disminución del grado alcohólico. En la destilación se estima que se recoge todo el anhídrido sulfuroso que contiene el vino, la mitad del ácido acético y una parte de gas carbónico que se redisuelve en el destilado en el momento de la condensación.
Se ha determinado que :
- 300 mg de anhídrido carbónico bajan el grado alcohólico en una décima.
- 200 mg de anhídrido sulfuroso bajan el grado alcohólico en una décima.
- 1,5 g de Acido Acético bajan el grado alcohólico en una décima.
También se puede neutralizar el vino con 7 a 8 ml de lechada de cal al 10%, esta dosis es superior en un 30% a 50% a la dosis estrictamente necesaria para obtener la neutralización, este exceso no produce problemas aunque se destile el amoníaco, ya que el vino tiene muy rara vez más de 20 mg de amoníaco por litro y la destilación de esta cantidad produciría un error de 1/100 de grado, por otra parte, la cal no alcaliniza lo suficiente como para producir la descomposición de las materias nitrogenadas del vino.
4.Para evitar que se formen burbujas demasiado grandes durante la ebullición, en los vinos ricos en anhídrido carbónico y sustancias muscilaginosas (en general vinos nuevos), se agrega un poco de tanino, piedra pómez o también algunas piedras pequeñas bien limpias.
5.Se conecta el matraz de 500 ml al refrigerador, teniendo el cuidado de ajustar bien los tapones de goma. En el extremo del refrigerante, se coloca el mismo matraz de 200 ml en que se midió el vino, luego se da el paso al agua del refrigerante y se procede a calentar el matraz de 500 ml.
6.Se destila, teniendo cuidado que no pasan burbujas de vino desde el matraz de 500 ml al refrigerante, hasta completar por lo menos 150 ml de destilado y se procede a aforar el matraz a 200 ml, y llevando a la misma temperatura a la que se aforó el vino, para esto se enfría el matraz en agua con hielo hasta la temperatura deseada.
De esta manera se obtiene la solución hidroalcohólica en la que se puede determinar su graduación por diversos métodos.
Separación del alcohol por arrastre con vapor de agua :
Este aparato es más complicado que el utilizado para la destilación ordinaria, pero permite efectuar la destilación en forma mucho más rápida y sin el riesgo de pirogenar las materias extractivas, las que dan sustancias tensio-activas volátiles
El sistema utilizado es similar al de destilación ordinaria, pero en este caso no se calienta el vino directamente, sino que se dispone de un generador de vapor de agua y un circuito que lleva este vapor al matraz donde se encuentra el vino, para arrastrar el alcohol. En este caso es necesario recoger un volumen de destilado igual al 95% del volumen del vino inicial.
A.2.) Determinación del alcohol por Aerometría.
El alcohómetro debe tomarse siempre por la extremidad superior del vástago y jamás por el flotador ; frecuentemente se debe lavar con alcohol puro y luego con éter, para extraer las materias grasas que pueden haberse adherido, y luego se seca con papel filtro. Igualmente, se debe controlar cada cierto tiempo, ya sea en agua destilada en la cual debe marcar 0º a 15ºC en una solución de alcohol al 10%, preparada a partir de alcohol absoluto.
1.Los 200 ml de destilado obtenidos, se llevan a una temperatura vecina a 20ºC y se introducen
en una probeta de 250 ml sin hacer ningún lavado, dejando escurrir el líquido hasta la última
gota. Luego se introduce el alcohómetro, limpio y seco, que se suelta con un suave
movimiento giratorio, el que debe flotar libremente en la probeta.
2.Una vez que el alcohómetro ha cesado en su movimiento vertical, se efectúa la lectura, por
debajo del menisco y horizontalmente a la superficie del destilado, que nos indica el grado
alcohólico.
3. Inmediatamente después, se saca el alcohómetro y se procede a tomar la temperatura del destilado en el centro de la probeta. El destilado deberá estar a 20ºC para que no exista error en la lectura.
Método Ebullométrico.
El método ebullométrico de determinación del alcohol, está basado sobre la temperatura de ebullición del líquido. El agua hierve por definición, a 100ºC a una presión de 760 mm de mercurio, el alcohol absoluto, en la mismas condiciones, tiene su punto de ebullición a 78ºC. Una mezcla de agua y de alcohol, cuya composición se mantiene constante por un refrigerante a reflujo, tiene a la misma presión, un punto de ebullición que se encuentra entre estas dos temperaturas. Entre más rica en alcohol sea la mezcla, más bajo será su punto de ebullición.
Determinación :
El ebullómetro está constituido por una caldera metálica que es calentada por un mechero al alcohol, sobre la parte superior se adapta un refrigerante y un termómetro.
1.Determinación del punto de ebullición del agua : se miden en la probeta que acompaña al aparato 15 ml de agua, que corresponde al primer aforo de ella y se introducen en la caldera, se introduce el termómetro y se atornilla el refrigerante, pero sin agua en su interior. Con esta cantidad de agua agregada, el termómetro sólo medirá la temperatura de los vapores de agua y no la del agua misma, ya que ésta tiene una serie de impurezas que alterarían su punto de ebullición, por lo que es indiferente tomar agua de la llave o destilada. Luego se calienta hasta que se estabilice la columna de mercurio del termómetro ; esta temperatura obtenida se hace coincidir con el 0 (cero) de la regla para el cálculo del grado alcohólico.
2.Determinación del punto de ebullición del vino : se vacía la caldera y se enjuaga con el mismo vino que se va a analizar. Se miden en la probeta 50 ml de vino, que corresponden al segundo aforo de ella, y se introducen en la caldera, luego se coloca el refrigerante lleno con agua fría y el termómetro. En este caso el termómetro medirá la temperatura de ebullición del líquido hidroalcohólico. Se calienta y se determina el punto de ebullición igual que en el caso anterior.
3.Una vez obtenido el punto de ebullición del vino, se ve en la regla que trae el aparato el grado alcohólico corresponde.
Causas de errores en la lectura.
Diversas influencias causan error en la lectura:
- Presión atmosférica : Cuando la presión varía, los puntos de ebullición varían también. Esta variación no es del mismo orden para el agua y para las soluciones hidroalcohólicas, pero en la práctica se corrige la temperatura de ebullición de la mezcla según la temperatura de ebullición del agua. Sin embargo, para una diferencia de presión de 40 mm de mercurio, la diferencia en el punto de ebullición del agua es de 1,38ºC, en cambio la diferencia relativa a un vino de 13º de alcohol es solamente de 0,45ºC.
- Influencia de los constituyentes del extracto : La determinación del punto de ebullición, se aplica en la práctica directamente al vino. Está expuesto a un error, débil si el vino es sano y está completamente fermentado, pero muy fuerte en el caso de vino alterados o vinos dulces ; este error se debe a que el vino no es solamente una mezcla de agua y alcohol, sino que contiene numerosas sustancias en disolución, unas volátiles, otras fijas que intervienen de una manera sobre la temperatura de ebullición de la mezcla.
- Los azúcares y las sales bajan la temperatura de ebullición, provocando un aumento del grado alcohólico. Las sustancias de bajo peso molecular poseen un efecto contrario. Se admite una compensación entre estos dos efectos.
- La determinación ebullométrica que se hace inmediatamente después de la determinación del punto de ebullición del agua, da generalmente un resultado más bajo que las que le siguen ; esto se debe a que los primeros vapores hidroalcohólicos que llenan el espacio vacío y humedecen por condensación las paredes del refrigerante, provocan una desalcoholización del vino, por lo que indicará un grado alcohólico inferior al real.
-Otra causa de error es la variación de la intensidad de la llama de la lámpara de alcohol.
En resumen, los métodos ebullométricos son los más prácticos, ya que presentan el mínimo de dificultades, son rápidos, pero no se debe olvidar que dan un exactitud de + 0,2º cuando se han realizado en un buen aparato y con las precauciones necesarias.
El ácido tartárico es el más importante de los ácidos fijos del vino, el más fuerte y más disociado de los ácidos orgánicos, por lo tanto el pH depende de él en su mayor parte. Influye notablemente en el color, en la resistencia a enfermedades y en el sabor ácido del vino, es el que más resiste la acción de las bacterias, no obstante ello puede ser atacado por "la tourneé" que lo descomponen con formación de ácido láctico y aumentando la acidez volátil.
Se encuentra en forma dextrógira que, suele estar acompañado de un isómero inactivo. Es muy resistente a la oxidación respiratoria en la uva, esto es lo que explica que se encuentre en mayor proporción que los otros.
Su proporción en los vinos está comprendida entre 1,80 g y 4,50 g por mil, siendo las cifras más corrientes alrededor de 3,0 g por mil.
Su concentración disminuye por precipitación del bitartrato potásico durante la fermentación, y después, por la acción del frío y más lentamente, por precipitación del tartrato neutro de calcio. Está autorizado y es útil su adición en la vendimia, cuando la acidez total es muy baja, cercana a 3 g/l.
2.Se filtra lavando el matraz tres veces con unos 5 ml de alcohol en cada oportunidad y luego el filtro igual número de veces. El filtro se introduce en el mismo matraz en que se hizo la precipitación y se agrega unos 150 ml de agua caliente para disolver el cremor precipitado. Una vez frío se titula con NaOH N/10 usando fenolftaleína como indicador.
3.El consumo de NaOH N/10 multiplicado por
el factor 1,88 da el ácido tártrico expresado en gramos por
litro de tartrato ácido de potasio, a cuyo valor hay que agregarle
dos décimas (0.2) que corresponde a la cantidad de bitartrato que
se solubiliza en el alcohol.
Acidos Tartárico, Málico, Láctico y Succínico.
Este tipo de ácidos se pueden determinar de variadas formas, sin embargo se requeriría de una instrumentación especializada para cuantificar cada uno de ellos, existen laboratorios capaces de desarrollarlo, pero no es el objetivo de este laboratorio. Para ello entonces se realizará una determinación cualitativa de estos ácidos por cromatografía sobre papel, la que permite separar los ácidos orgánicos que se encuentran en el vino y por comparación de soluciones puras se puede apreciar la existencia de cada uno de los mencionados.
Es de fundamental importancia determinar la presencia de ácido málico en vinos tintos, u ausencia, ya que con ello se confirma el desarrollo de la fermentación maloláctica, pudiendo al término de ella realizar el trasiego correspondiente y dejar el vino en mantención.
Procedimiento.
1.En un papel Whatman Nº1, rectangular de 19 x 45 cm, se traza una línea con lápiz de grafito a 3 cm del borde inferior, sobre la cual se siembran cada 2,5 cm las gotas de vino a estudiar con la ayuda de una micropipeta o jeringilla.
2.Con la jeringilla o micropipeta, que ha sido lavada previamente en alcohol al 50%, se procede a colocar 2 gotas de cada solución testigo y de los vinos a analizar. Se deberá esperar que seque cada una de las gotas.
3.Una vez seco el papel, después de la segunda gota, se coloca en una cubeta que contiene el solvente, mojando tan sólo el borde inferior de la hoja, se cierra la cubeta en forma hermética.
4.El solvente esta formado por: 200 ml de N-Butanol + 200 mg de Azul Bromofenol, Acido Acético Glacial al 50%, las dos soluciones se mezclan en proporción de 200 y 100 ml respectivamente y se coloca en la cubeta, la que debe quedar tapada siempre para evitar la pérdida de los gases.
5.Una vez que el frente del solvente ha llegado a 2 o 3 cm del borde superior de la hoja, se saca el cromatograma y se procede a secarlo en corriente de aire frío y a la sombra para su revelación.
6.Al revelado se muestra de fondo azul y con manchas amarillas.
7.Los ácidos del vino se separan en el siguiente orden: en la parte más baja se fija el ácido tartárico, al centro el ácido málico y en la parte superior el ácido láctico y succínico.
Resultados
Se compara el tamaño e intensidad de las manchas de color amarillo de las soluciones testigo, con las de los vinos a analizar ( las manchas que se encuentran a la misma altura corresponden al mismo ácido). Si un vino no contiene Acido Málico significa que ya ha sufrido su Fermentación Maloláctica.
Polifenoles Totales (Indice de Permanganato).
Este método esta basado en la propiedad del permanganato de oxidar en frío, la suma de sustancias oxidables del vino que comprende a los polifenoles. Esta determinación se puede efectuar directamente sobre el vino, teniendo en cuenta aproximadamente el efecto de los ácidos orgánicos y del alcohol del vino. Esta es una determinación global que recibe el nombre de Indice Permanganato y que está en relación con los caracteres de la dureza, astringencia o suavidad, sin que la relación sea absoluta ya que existen otros factores que intervienen en esos caracteres, como el pH, acidez volátil, etc.
El valor de este Indice es:
-25 a 35 para los vinos rosados.
-Alrededor de 50 para los vinos tintos muy suaves.
-Alrededor de 60 para los tintos suaves.
-75 y más para los vinos tintos duros y astringentes.
-100 a 150 para los tintos prensas.
A) Método Ribereaux-Gayon y Maurié:
1. Para efectuar este análisis es necesario preparar la siguiente solución; 50 cc de solución a 3 g/l de Carmín Indigo filtrado + 50 cc de ácido sulfúrico a 1/3 + 900 cc de agua destilada.
2. Se toman 50 cc de la solución anterior y se le agregan 2 cc de vino.
3. Se procede a titular con Permanganato de Potasio N/100 hasta la desaparición del color azul y la aparición de un color amarillo franco. En los vinos nuevos cuando el viraje no es muy claro es recomendable tomar sólo 1 cc de vino. Sean "M" los cc gastados.
4. Se efectúa luego una titulación similar a la indicada, reemplazando los 2 cc de vino por una solución de Acido Tartárico a 5 g/l neutralizada a la mitad y que contenga un 12% de alcohol. Sean "N" los cc gastados.
Cálculo:
(M - N) 500 = cc / lt de Permanganato de Potasio N/100.
(M - N) 5 = Miliequivalentes / litro de Permanganato de Potasio.
(M - N) 5 = Indice de Permanganato.
La solución de Permanganato de Potasio N/100 es de por sí muy inestable y su concentración disminuye rápidamente, por lo que se debe preparar en el momento de usar, a partir de una solución N/10 de título exacto.
El ácido metatartárico es utilizado para estabilizar, en forma química, la cristalización por parte del Acido Tártrico el cual precipita al someter al vino a bajas temperaturas y al agregar metatartárico es éste compuesto el que reacciona por un tiempo con el ácido tártrico evitando su cristalización. Principalmente se utiliza en vinos corrientes, que tienen destino a garrafa. En el caso de vinos finos la estabilización se realiza por medio de una baja de temperatura, -2 a -3 ºC, sin que ocurra congelación del vino y donde la mayor cantidad de ácido tártrico precipita en forma rápida a la forma de cristales.
El ácido metatartárico es utilizado de las cristalizaciones tartáricas, bitartrato de potasio y tartrato neutro de potasio. Se emplea en dosis de 5 a 10 gramos por hectolitro. Sin embargo, la eficiencia del producto depende de su índice de esterificación, el cual varía según las condiciones en que ha estado almacenado, éste índice debe ser de 36 a 40 % para los buenos productos, como mínimo.
La acción del ácido metatartárico en el vino depende de la temperatura del vino durante su conservación, con temperaturas altas se produce una hidrólisis del ácido lo que acarrea una disminución del índice de esterificación, es muy soluble al agua y al alcohol.
Su eficacia es de:
- 2 años a una temperatura de 10ºC.
- 18 meses a una temperatura de 15ºC.
- 12 meses a una temperatura de 18ºC.
- 4 meses a una temperatura de 20ºC.
- 1 mes a una temperatura de 25ºC.
El índice de esterificación deberá ser un análisis de confirmación de la calidad del Acido Metatartárico que se vaya a utilizar.
Procedimiento
1.Disolver 0,1 g aproximadamente del ácido metatartárico en agua destilada fría (10 - 20 cc). El pesaje debe ser muy rápido, ya que se pierde.
2.Titular su acidez con NaOH N/10 en presencia de fenolftaleína, donde el gasto de NaOH N/10 corresponde a n.
3.Agregar un exceso de NaOH igual a lo gastado y dejar reposar una hora para que se produzca la saponificación.
4.Después de la hora se titula el exceso de NaOH que no reaccionó con Acido Sulfúrico N/10, correspondiendo el gasto de ácido a n’.
Cálculo:
Indice de Esterificación (%) = n - n’ / n + (n-n’)
HOME
INICIO
Benzoato
de Sodio y Sorbato de Potasio.
La utilización de estos productos es con el objetivo de establecer un control sobre los microorganismos, levaduras principalmente, evitando el deterioro por parte de ellos. Su uso se encuentra enfocado a vinos dulces o semidulces, con un contenido de azúcares reductores alto por sobre los 5 g/l, donde existe mayor riesgo de refermentaciones o enturbiamientos producidos por levaduras. Sin embargo dependerá también de las condiciones de envasado con que cuente la bodega, aunque se trabaje con vinos secos. En un sistema abierto, donde los microorganismos tienen poco o nulo control, condición actual de la mayoría de los productores envasadores, son de rigurosa aplicación para evitar posibles avinagramientos en el envase, con la consecuente pérdida de calidad del producto. Estos elementos serán analizados por laboratorio externo calificado.
El uso de Benzoato tiene el objetivo de prevenir refermentaciones por levaduras, sin embargo se le atribuye una acción interesante sobre bacterias. Asu vez, el uso de Sorbato sólo posee acción sobre las levaduras, no así sobre bacterias que incluso lo pueden descomponer con la consecuente aparición de olores extraños. Vale mencionar el hecho que como condición "sine qua non" la presencia de anhídrido sulfuroso para la acción de estos estabilizantes.
En Chile los contenidos máximos permitidos por el Reglamento son de 180 mg/l de ácido benzoico y de 200 mg/l para el ácido sórbico o sus sales.
Aunque existen otros productos estabilizantes, su uso no esta autorizado en Chile ni en ningún países que importa vinos desde Chile, considerándose causal de rechazo. El ácido sórbico se encuentra prohibido en Austria y no es aceptado en Dinamarca y Japón. El ácido benzoico se encuentra prohibido en la mayoría de los países vitícolas y también en el Japón.
LA
INFORMACION AQUI PRESENTADA ES SOLO UN TIPO DE METODOLOGÍA, Y NO
ES NECESARIAMENTE LA MEJOR, SINO MAS BIEN LA MAS FACIL DE ADAPTAR A DISTINTAS
CONDICIONES, CUALQUIER SUGERENCIA FAVOR HACERLA LLEGAR POR E-MAIL
Jledesma inc. 1999, Todos los derechos reservados