Líquidos
Albert R. Moreira | Alex R. Gomez |
Andre Luis F. Araújo | Kassyo P. A. Reis |
| Marcos Portnoi | Marcus Vinicius A. da Costa Fo |
Rafael G. B. de Araújo |
Engenharia Elétrica – UNIFACS
Química Geral
20.Julho.1999
http://surf.to/locksmith
Índice
**
Congelamento e Supercongelamento
***
Equilíbrio e o Princípio de Le Châtelier
**Equilíbrio Líquido-Gás e Variações de Temperatura
*Equilíbrio Líquido-Gás e Variações de Pressão
*Equilíbrio Sólido-Líquido e Variações de Temperatura
****
Analisar propriedades do estado líquido da matéria e definir suas características. Estudar os efeitos da pressão, temperatura e interações intermoleculares no estado líquido. Observar diagramas de fase, de mudanças de estado e equações do estado líquido. Compreender as mudanças no comportamento dos líquidos quando solutos são adicionados a eles.
Líquidos são geralmente imaginados como sendo um estado "intermediário" da matéria entre sólidos e gases, visto que a passagem usual de um sólido para o estado gasoso atravessa a fase líquida. Propriedades dos líquidos dão suporte a essa visão, como por exemplo as velocidades de difusão e escoamento, que são menores que as dos gases, porém maiores que as dos sólidos. A queda de uma pessoa na água acima de certa altura pode provocar ferimentos graves ou morte, o que demonstra que a água líquida é seguramente dura, apesar de o sê-lo menos que um sólido.
Num líquido, as moléculas estão bastante próximas, quase tão próximas quanto em um sólido, porém apresentam um grau de desordem semelhante a um gás. Essa estrutura é responsável pelas características do estado líquido.
A formação do líquido tanto pode ser através da fusão de um sólido, como pela condensação de um gás. Durante a fusão, a energia absorvida produz uma diminuição das forças atrativas entre as moléculas, íons ou átomos no sólido. Na condensação, a energia é liberada para o meio ao tempo em que as moléculas são mais unidas pelas forças de atração (a união das moléculas nesse caso é um processo exotérmico). Um líquido se assemelha a um sólido porque suas moléculas estão bastante próximas umas às outras, porém em estrutura desordenada, e aí há uma semelhança com os gases. Verifiquemos pois as propriedades dos líquidos e porque eles assim o são.
Líquidos têm viscosidade intermediária entre sólidos e gases: menor que os gases, e maior que os sólidos.
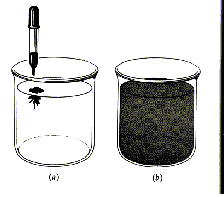
Essa viscosidade intermediária permite que os líquidos escoem com certa facilidade e sejam bastante fluidos. Assim, os líquidos tomam a forma do recipiente em que estão contidos. Entretanto, um líquido não se expande para ocupar todo o recipiente; mantém-se com um volume determinado. A fluidez de um líquido demonstra que suas moléculas possuem maior liberdade para se movimentar do que as de um sólido, entretanto a viscosidade relativa mostra ainda a presença de forças intermoleculares elevadas.As velocidades de difusão de um líquido tendem a ser intermediárias entre as dos sólidos e as dos gases. O contato íntimo e próximo entre as moléculas de um líquido limitam até um certo ponto sua capacidade de se mover. Essa característica é responsável pela relativa lentidão em que um líquido se difunde através de outro. Uma gota de leite pingada em café preto, por exemplo, pode ilustrar a velocidade de difusão. É possível observar perfeitamente o leite difundindo-se lentamente no café, e só efetivamente formando uma mistura de cor única após bastante tempo, se não houver agitação.

Figura 1: Difusão em líquidos. Uma gota de tinta é adicionada à água, e se difunde lentamente através dela.
Líquidos são muito menos compressíveis que gases.
Efetivamente, pressões muito elevadas são necessárias a fim de reduzir o volume de um líquido significativamente, o que os torna, no uso prático, quase incompressíveis, semelhantes a um sólido. Isso é resultado do pouco espaço entre as moléculas de um líquido, havendo pois repulsão entre as nuvens de elétrons das moléculas vizinhas que oferece resistência à aproximação. Essa propriedade revela-se útil quando usada, por exemplo, para transmitir forças poderosas a distância, capazes de levantar objetos extremamente pesados. Prensas hidráulicas e elevadores hidráulicos são exemplos típicos. Forças são exercidas numa ponta de condutores tubulares e transmitidas pelo líquido imcompressível até outra ponta, onde exercem trabalho. Se houvesse compressibilidade significativa, grande parte da força original seria perdida no processo.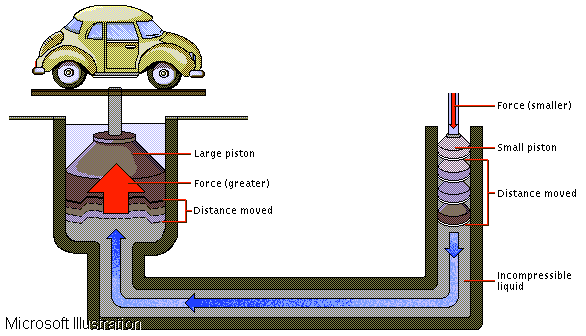
Figura 2: Elevador hidráulico. Uma pequena força exercida no pistão menor exerce uma força muito maior no pistão grande, capaz de erguer um carro. O prejuízo é que o deslocamento produzido é muito menor.
Líquidos exibem tensão superficial.
Tensão superficial é a tendência de um líquido a minimizar sua área superficial, ocorrendo porque as moléculas na superfície são atraídas pelas moléculas de dentro do líquido, mas não de "fora". As moléculas que estão na superfície do líquido, portanto, experimentam uma resultante de forças que as impele para "dentro" do líquido. Para se alterar a superfície de um líquido, força deve ser aplicada de forma a movimentar essas moléculas, realizando trabalho. Esse gasto de energia é a tensão superficial. A tensão superficial é conseqüência direta das forças de atração intermoleculares. Sendo assim, quanto maior essas forças num líquido, maior será sua tensão superficial. Similarmente, com o aumento da temperatura, a tensão superficial diminui, pois as moléculas, absorvendo energia, aumentam sua energia cinética e a eficiência dessas forças atrativas diminui.O estado de menor energia para um volume de líquido é quando sua área superficial é mínima, de modo que haja o menor número de moléculas na superfície que possuem alta energia. O melhor formato para isso é uma esfera, e esta é a razão pela qual gotas de água são aproximadamente esféricas. Todo líquido tende ao formato esférico, como comprovaram experimentos em ausência de gravidade. É possível confeccionar esferas metálicas com extremo grau de perfeição em órbita terrestre, onde a resultante gravitacional é nula. Um metal fundido, portanto líquido, assumirá o formato esférico, e assim ficará ao se solidificar novamente.
O líquido possui uma propriedade interessante, que é a sua tendência de evaporar ou vaporizar, transformando-se num gás. Esse efeito advém do fato de que num líquido, como em qualquer estado da matéria, as moléculas apresentam velocidades variáveis. Nem todas apresentam a mesma energia cinética. Umas movimentam-se rapidamente, outras lentamente, outras ainda virtualmente paradas. Quanto maior a temperatura do líquido, maior a fração de moléculas com alta energia cinética, e quanto menor a temperatura, menor será esta fração.
Num dado instante, algumas moléculas na superfície do líquido adquirem energia cinética suficiente para vencer as forças de atração intermoleculares, e escapam do líquido. Este é o fenômeno da evaporação.
Essas moléculas, movimentando-se mais rapidamente, conseguem vencer as forças de atração e se "desprendem" das demais, deixando o líquido. A saída gradativa dessas moléculas mais rápidas, deixando as mais lentas no líquido, ocasiona um decréscimo na energia cinética média do líquido. Ou seja, representa uma diminuição na temperatura. Esse fenômeno é conhecido como resfriamento por evaporação, que é o responsável pela sensação de frio ao se sair de uma piscina, ao vento. Esse efeito também é útil, quando usado em refrigeradores de evaporação, ou ainda em cantis de lona e as "moringas". Uma moringa é um recipiente feito de barro, usado para guardar água para beber, e tem o efeito de deixá-la levemente resfriada. Isso acontece porque o barro, sendo poroso, deixa escapar algumas moléculas de água para o exterior do recipiente, tipicamente as de maior energia cinética. Esse escape, uma evaporação, reduz a temperatura da água no interior da moringa.
Em temperaturas elevadas, a energia cinética média das moléculas é maior, e mais delas podem atingir o nível mínimo a fim de escapar das forças intermoleculares. Por isso, líquidos aquecidos evaporam mais rapidamente. Do mesmo modo, uma grande área superficial permite que mais moléculas estejam em contato com o meio externo ou que mais moléculas rápidas possam atingir a superfície e escapar. Assim, uma maior área superficial aumenta a velocidade da evaporação.
Também a intensidade das atrações intermoleculares influi na velocidade da evaporação. Se as forças são fracas, a uma dada temperatura mais moléculas podem atingir a energia mínima de escape. Se as forças são mais poderosas, sob a mesma temperatura, então menos moléculas terão essa energia mínima para evaporar. Isso explica porque sólidos não evaporam facilmente, já que suas forças intermoleculares são muito possantes se comparadas a um líquido.
O experimento demonstrado na Figura 3 consiste em um recipiente contendo água colocado dentro de uma campânula de vidro munida de um manômetro. O recipiente é preenchido com água pura e tampado, retirando-se posteriormente o ar da campânula. Ao se retirar a tampa do recipiente por meio remoto, a água evapora, e a presença destas moléculas de água em forma de gás acusam um valor de pressão no manômetro. O volume de líquido abaixa ligeiramente e a pressão aumenta até um determinado limite, quando aparentemente nada mais acontece.
Na realidade, moléculas de água ainda estão evaporando, porém igual número de moléculas de água, na fase gasosa, estão sendo recapturadas pelo líquido, presas pelas forças intermoleculares. Este fenômeno de condensação aumenta de velocidade à medida em que a concentração de moléculas na fase gasosa aumenta, pois então mais moléculas de gás terão contato com a superfície do líquido e poderão por ele ser capturadas. Eventualmente, a velocidade de retorno das moléculas para o líquido tornar-se-á bastante elevada a ponto de se igualar à velocidade de escape. Ou seja, a velocidade de condensação iguala-se à velocidade de evaporação. Neste momento, não há aumento global na transferência de moléculas do líquido para o gás, permanecendo a pressão da campânula constante.
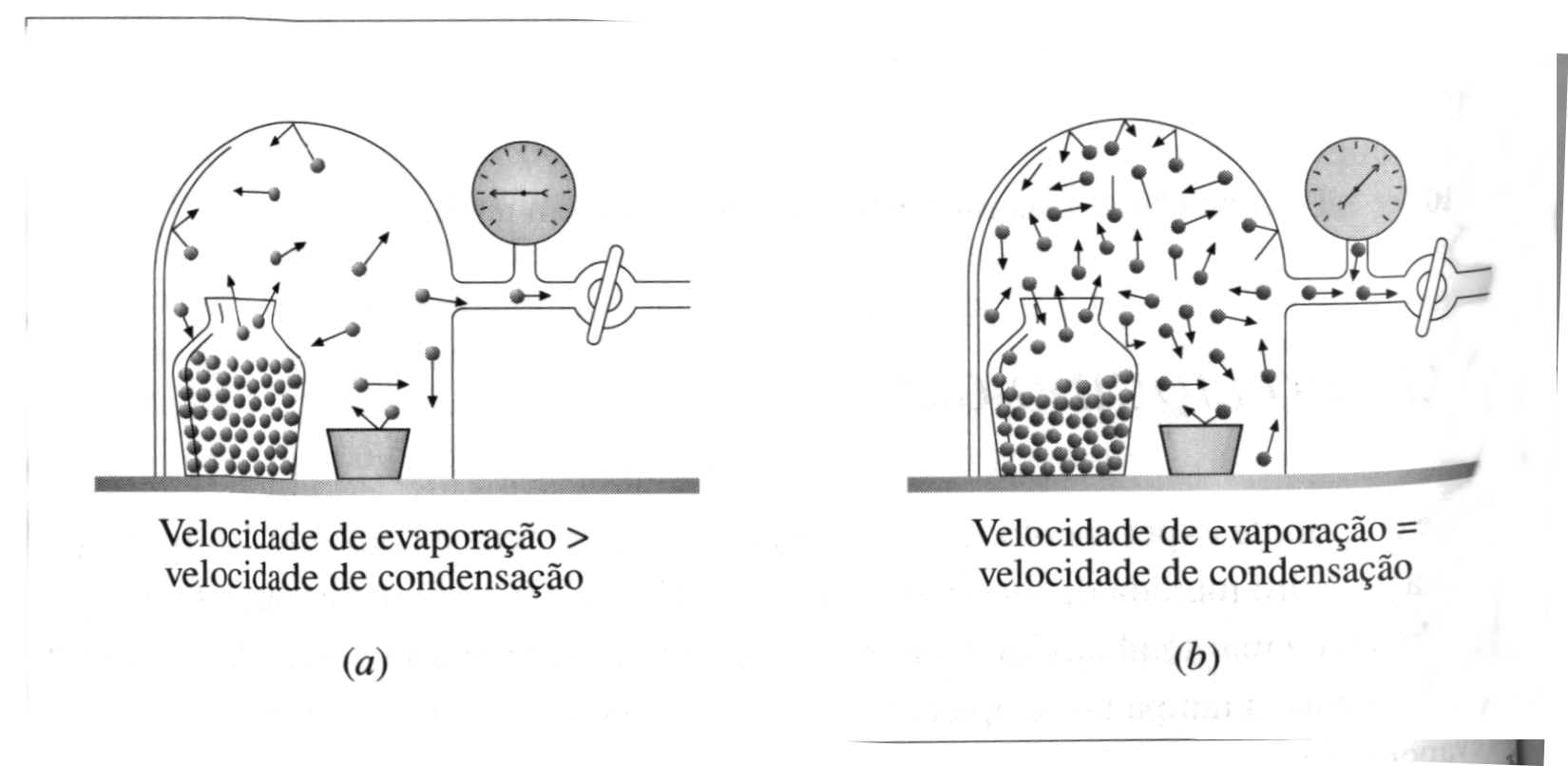
Figura 3: Equilíbrio da pressão de vapor. (a) imediatamente após abertura da tampa, sistema ainda não em equilíbrio. (b) em equilíbrio.
Este é um estado de equilíbrio dinâmico, onde duas reações ou processos opostos ocorrem na mesma velocidade. Assim, aparentemente o sistema dentro da campânula está "parado", entretanto moléculas ainda saem do líquido e moléculas ainda são por ele captadas, só que em mesma velocidade. Isso pode ser representado na forma abaixo:
H2O(l) Á H2O(g)
A seta dupla representa as duas transformações, evaporação e condensação, ocorrendo na mesma velocidade.
A pressão exercida por um gás em equilíbrio com o seu estado líquido é chamada de pressão de vapor de equilíbrio do líquido, ou simplesmente pressão de vapor do líquido. Essa pressão depende da tendência de escape das moléculas do líquido. Se as forças intermoleculares são fracas, as moléculas escapam com mais facilidade, resultando em mais gás no meio e aumentando a pressão de vapor, portanto. Em adição, o aumento da temperatura também aumenta a pressão de vapor, uma vez que mais moléculas podem atingir o limite mínimo de energia cinética para escapar do líquido, resultando em mais moléculas em forma gasosa.
A pressão de vapor não depende do volume do reservatório.
Quando a temperatura se torna suficientemente elevada, a tendência de escape das moléculas de um líquido torna-se tão grande que ocorre ebulição. Na ebulição, formam-se bolhas de gás no corpo do líquido, que então saem para o meio. Essas bolhas se formam a partir de pequenos núcleos de bolhas ou microbolhas, contendo algumas moléculas. Essas microbolhas atuam como centro de captação e crescimento, aos quais outras moléculas suficientemente aquecidas aderem, aumentando a bolha enquanto esta sobe para a superfície. As bolhas se formam somente quando a pressão de vapor do líquido torna-se igual à pressão externa exercida pela atmosfera sobre o líquido (pois caso contrário a atmosfera exerceria pressão suficiente para comprimir as bolhas de volta ao estado líquido). Devido a isso, o ponto de ebulição, ou seja, a temperatura na qual o líquido entra na fase de ebulição, depende da pressão atmosférica. Quanto maior a pressão atmosférica, então maior a pressão de vapor, e maior ou mais alto o ponto de ebulição.
Similarmente, à menor pressão, o ponto de ebulição cai. Se batatas fossem cozidas em elevada altitude, a água entraria em ebulição em temperatura menor. Como a ebulição mantém a temperatura estável do líquido até que todo ele tenha evaporado, essas batatas cozinhariam em menor temperatura que ao nível do mar, resultando em maior tempo necessário de cocção.
Vejamos o mecanismo de cozimento numa panela de pressão. Este tipo de panela é vedada e munida de uma válvula aliviadora de pressão no topo. Ao esquentar a água, mais e mais moléculas evaporam, aumentando a pressão no interior da panela, até que a válvula atinja seu limite e comece a liberar o excesso de pressão. A pressão neste momento no interior da panela é maior que 1 atm, e somente agora a água pode ferver, porém a uma temperatura mais elevada, o que efetivamente diminui o tempo de cocção.
Calor de vaporização é a quantidade de energia necessária para evaporar um mol de líquido. Quanto maior este calor, maior então a intensidade das forças de atração intermoleculares neste líquido.
Foi dito anteriormente que um líquido entra em ebulição quando sua temperatura torna-se alta o suficiente para que a pressão de vapor exceda a pressão atmosférica. Este é um comportamento ideal, entretanto, porém há casos em que é possível aquecer um líquido acima de seu ponto de ebulição, sem que o mesmo ebula. Isso ocorre quando não há a formação das microbolhas, devido à baixa probabilidade desta formação em diversos líquidos. Em não se formando os núcleos de bolha, o líquido continua a se aquecer, excede seu ponto de ebulição e assim prossegue, até que uma simples microbolha consiga se formar. Neste momento o líquido ebule violentamente, num efeito muitas vezes explosivo.
Esta transformação explosiva de grande quantidade de líquido em vapor abaixa a temperatura do líquido, à medida em que o calor de vaporização se consome. Esta cai até o ponto de ebulição, e então o líquido ebule normalmente, ou ainda pode voltar a superaquecer. Este comportamento resulta em flutuação da temperatura e numa ebulição descontrolada, que pode projetar líquido para fora do recipiente. A ebulição pode ser melhor controlada facilitando a formação das microbolhas, adicionando pérolas de vidro no recipiente. São cacos de material poroso, que trazem consigo ar retido e este ar serve como núcleo de crescimento das bolhas. Imperfeições no recipiente onde o líquido está contido também auxilia a formação dos núcleos de bolha.
Curvas de Pressão de Vapor para Líquidos
A pressão de vapor dos líquidos é uma função da temperatura. A Figura 4 demonstra as curvas de pressão em função da temperatura de algumas substâncias.
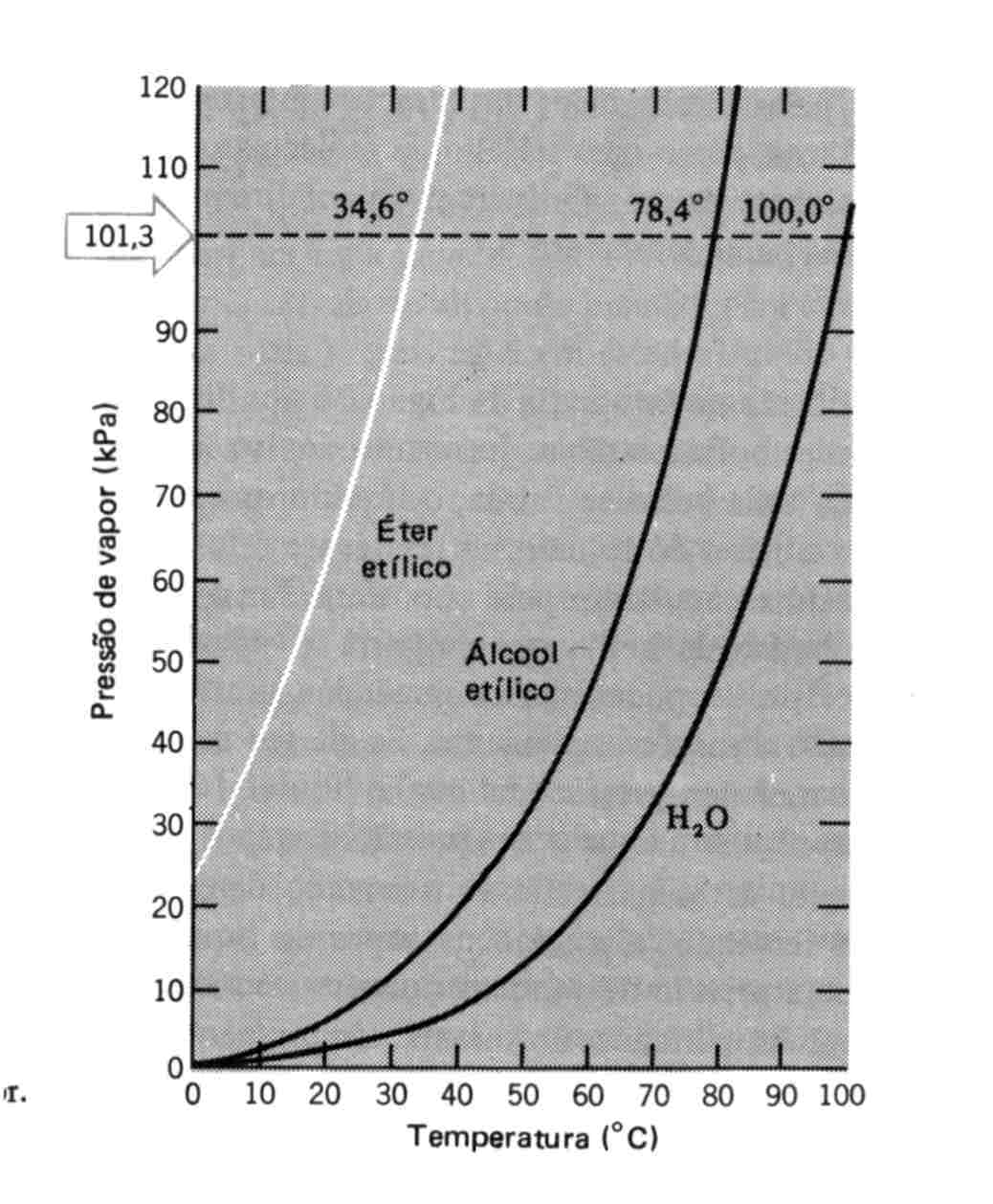
Figura 4: Curvas de Pressão de Vapor
A temperatura máxima na qual existe distinção entre fase líquida e sólida recebe o nome de temperatura crítica, Tc. A pressão de vapor na temperatura crítica recebe o nome de pressão crítica, Pc. O encontro dos dois pontos é o ponto crítico.
A forma geral da equação de Clausius-Clapeyron abaixo, obtida através da linearização das curvas, permite calcular algumas variáveis.
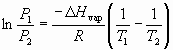 ,
,
onde
· D
Hvap é o calor de vaporização·
P1 e P2 são duas pressões de vapor do mesmo líquido·
T1 e T2 são as duas temperaturas do mesmo líquido, nas pressões correspondentes
Variação da Pressão de Vapor com a Temperatura
Estuda-se esta relação a partir da equação de Clausius-Clapeyron:
LnP=(-D Hvap/R)(1/T)+b
Esta fórmula é útil para:
a)Conhecer D Hvap de líquido quando a pressão de vapor for conhecida em duas temperaturas diferentes.
b)Conhecer a pressão de vapor de um líquido numa temperatura de um líquido numa dada temperatura quando o calor de vaporização (D Hvap) e a pressão de vapor em outra temperatura forem desconhecidas.
c)Conhecer a temperatura na qual o líquido possui em determinado valor para a pressão de vapor, fornecendo calor de vaporização e pressão de vapor em alguma outra temperatura.
Para aplicar a relação de Clausius-Clapeyron, é necessário, antes, conhecer as variáveis em questão.
Por ser uma reta no gráfico, utiliza-se a equação da reta y=ax+b
Sendo que pode-se comparar as duas equações y=ax+b
LnP=m(1/T)+b
Logo pode-se afirmar que m é o coeficiente angular
M= -D Hvap/R implica em : lnP= -D Hvap/R(1/T)+b
Sendo que o calor de vaporização representa a variação de entalpia para o processo:
D
Hvap=D Hgás-D Hlíquido
M = -D Hvap/R m*R= - D Hvap
Coeficiente angular
M=(y2-y1)/(x2-x1)
M=(lnP)1-(lnP)2 / (1/T1)-(1/T2) aplica-se na fórmula D Hvap= - R*m
Outra forma de análise consiste de uma outra forma de equação de Clapeyron, por substituição na forma anterior, usando-se valores de pressão de vapor em duas temperaturas diferentes.
LnP1= -D Hvap/R(1/T1)+b
LnP1-lnP2= -D Hvap/R(1/T1-1/T2)
LnP2= -D Hvap/R(1/T2)+b
LnP1/lnP2= -D Hvap/R(1/T1-1T2)
Congelamento e Supercongelamento
Removendo-se energia de uma substância, a energia cinética média das moléculas reduz-se, e se a remoção fizer o líquido atingir sua temperatura de congelamento, então a partir deste ponto, a temperatura não mais diminua, até que todo o líquido esteja congelando. A remoção contínua de energia durante esse processo ocasiona o decréscimo na energia potencial média das moléculas.
O ponto de congelamento Tc (e o ponto de fusão Tf, que são idênticos se o sistema está em equilíbrio) de um sólido varia em grau menor com a pressão, apesar de ser uma variação não desconsiderável. A grandeza das forças de atração intermoleculares influi no calor necessário para fundir um sólido. Se o retículo cristalino for fortemente coeso, o ponto de fusão do sólido também será alto.
Da mesma forma que o superaquecimento, algumas substâncias podem ter sua temperatura diminuída abaixo do seu ponto de congelamento, sem que entretanto se solidifiquem. Para que o líquido se solidifique, é necessário que algumas moléculas se aproximem umas das outras de forma a formar um núcleo cristalino, que servirá de núcleo de crescimento para um cristal maior. Quando há dificuldade para formação desses núcleos de cristal, o líquido continua a perder calor, sua temperatura cai abaixo do ponto de congelamento, até que em algum lugar do líquido, o núcleo de crescimento consiga se formar. A cristalização ocorre em seguida, rapidamente, acompanhada de liberação de calor, o calor de cristalização. Essa liberação de calor é captada pelo líquido, que aumenta de temperatura média até o ponto de congelamento, e então este continua a congelar. Se a temperatura de supercongelamento for muito baixa, extrema, talvez a liberação de calor não seja suficiente para elevar a temperatura ao ponto de congelamento, situação esta em que o líquido permanecerá supercongelado, sem formar retículo cristalino de sólido.
Os vidros são líquidos altamente supercongelados, onde a temperatura foi removida de forma tão rápida para eles que não houve possibilidade de formação dos retículos cristalinos. Assim, esses líquidos ficam com uma viscosidade tão alta que a fluidez é quase nula, assemelhando-se dessa forma a um sólido – duro, rígido e com forma constante. Um vidro também é chamado de sólido amorfo, a exemplo de vidro de janela, alguns plásticos, cerâmicas e ligas.
Apesar da semelhança com os sólidos, as moléculas do vidro ainda fluem, apesar de fazê-lo muito lentamente. De fato, os vidros podem se cristalizar e até tornarem-se sólidos reais, apesar de ser um processo extremamente vagaroso. Vidros muito antigos revelam pequenos núcleos cristalinos dentro de si, resultado do encontro de moléculas na posição correta para a formação do retículo cristalino. Esses cristais individuais não se interligam fortemente, o que enfraquece o vidro e torna-o quebradiço. Ainda, vidros de janela antigos realmente são mais volumosos ou abaulados em sua parte de baixo que em sua parte de cima, resultado da lenta fluência do vidro sob efeito da gravidade.
Num líquido típico, as moléculas não têm um padrão de ordenamento. Elas movem-se com relativa facilidade, de forma que os líquidos podem escoar. Num sólido típico, as moléculas estão ordenadas em retículos cristalinos e neles estão presas rigidamente, o que dá a um sólido uma fluidez praticamente nula. Certas substâncias exibem propriedades de ambos os estados líquido e sólido, em uma faixa de temperatura imediatamente acima dos seus pontos de fusão, e são chamadas de cristais líquidos. Elas são fluidas, mas suas moléculas estão ordenadas, e podem também mudar esta ordenação sob efeito da passagem de uma corrente elétrica. Acima da faixa de temperatura, a ordenação é perdida e os cristais líquidos tornam-se líquidos comuns.

Figura 5: Arrumação de mesógenos (moléculas semelhantes a bastões) em estado sólido, cristal líquido e líquido.
Um cristal líquido típico é formado por moléculas chamadas mesógenos, que são moléculas assemelhadas a bastões. Três tipos básicos de cristal líquido são os nemáticos, esméticos e os colestéricos.
·
Os cristais líquidos nemáticos são caracterizados por moléculas que não têm ordem posicional, mas que tendem a apontar para a mesma direção.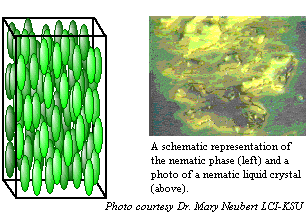
Figura 6: Moléculas de cristal líquido nemático e foto do cristal
·
A palavra "esmético" deriva da palavra grega para "sabão". Esta origem aparentemente ambígua é explicada pelo fato de que a camada de substância grossa e escorregadia freqüentemente achada no fundo das saboneteiras é na realidade um tipo de cristal líquido esmético. Moléculas em uma fase esmética de cristal líquido têm, além da ordem direcional dos cristais nemáticos, também uma ordem translacional, ou seja, tendem a se alinhar em camadas ou planos. Esta ordem mais apurada significa que o estado esmético é mais similar a um sólido que o estado nemático.
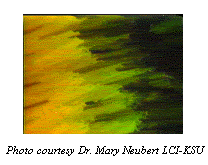
Figura 7: Cristal líquido esmético e sua foto em microscópio polarizado
·
Os cristais líquidos colestéricos são tipicamente compostos de moléculas mesogênicas nemáticas contendo um centro que produz forças intermoleculares as quais favorecem alinhamento entre as moléculas segundo ângulos ligeiramente diferentes um do outro. Isto resulta em uma estrutura que pode ser visualizada como uma pilha de "bolachas" ou camadas muito finas do tipo nemático, sendo que cada uma está orientada em ângulos diferentes em relação à anterior e à posterior.
Figura 8: Camadas de cristal líquido colestérico
As moléculas de um cristal líquido variam de arranjo de acordo com a temperatura, podendo passar da fase nemática para a esmética, e finalmente para a colestérica, dependendo do tamanho da molécula. Num cristal colestérico, a distância entre as camadas também varia de acordo com a temperatura. Uma vez que as moléculas muito finas destes cristais líquidos têm a propriedade de refletir diferentes comprimentos de onda de luz, de acordo com sua orientação, um cristal líquido colestérico pode ser usado para indicar variações de temperatura, uma vez que muda de cor de acordo com a temperatura aplicada a ele.
Outra utilização de extrema importância na tecnologia atual é em mostradores e displays de computadores e equipamentos. Um display de cristal líquido de relógio ou calculadora, o LCD (de Liquid Crystal Display) contém tipicamente um cristal líquido nemático. Um fino filme do cristal é imprensado entre duas placas de vidro transparente, que contém sulcos para abrigar o cristal e também eletrodos, segundo desenhos adequados. Ao fundo da bolacha de vidro, é colocado um material reflexivo, de modo a refletir a luz ambiente ou ainda lâmpadas para produzir iluminação independente. Ao se energizar um segmento, as orientações das moléculas no cristal líquido se modificam e a substância se torna opaca segundo uma faixa de ângulo de visão. É como se os cristais, originalmente alinhados paralelamente em relação à fonte de luz, fossem "entortados" sob efeito do campo elétrico e ficassem em posição perpendicular ou próximo a isso. A luz, dessa maneira, é bloqueada na passagem pela bolacha de vidro e não é refletida de volta, originando áreas escuras no display.
Estudemos um gráfico de curva de aquecimento, de modo a entender as mudanças de estado de acordo com a temperatura. A Figura a seguir traz a curva para uma substância hipotética.
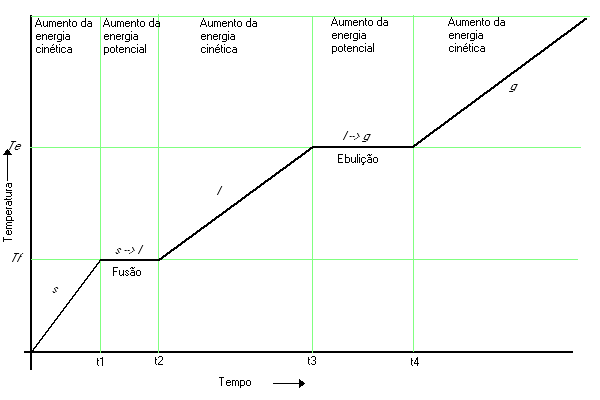
Figura 9: Curva de aquecimento
O calor começa a ser fornecido constante e lentamente ao sólido inicialmente próximo ao zero absoluto. A temperatura varia com o tempo, e à medida em que calor é fornecido, as moléculas vibram mais intensamente em suas posições no retículo cristalino. No ponto t1, as moléculas da superfície do sólido atingem energia cinética suficiente para quebrar as forças intermoleculares que as mantém unidas no retículo cristalino e distanciam-se de suas vizinhas. O sólido começa a se fundir.
Entre os instantes t1 e t2, a temperatura permanece constante, e este intervalo corresponde ao ponto de fusão Tf. O sólido funde-se gradativamente, absorvendo calor de fusão. A temperatura permanece constante porque não há aumento na energia cinética média das moléculas. O calor fornecido aumenta a energia potencial média destas.
No instante t2 todo o sólido fundiu e, à medida em que o calor continua a ser fornecido, a temperatura aumenta até que o tempo t3 seja alcançado. Durante este intervalo, a energia cinética aumenta, uma vez que as moléculas tornam-se crescentemente ativas (estado líquido).
Entre os instantes t3 e t4 há uma segunda zona de temperatura constante. Agora, temos o ponto de ebulição Te. O fornecimento contínuo de calor propicia a energia necessária para que as moléculas vençam as forças de atração intermoleculares do líquido e escapem para a forma gasosa. A quantidade de calor absorvido é o calor de vaporização.
Após o instante t4, a temperatura continua a subir porque o calor fornecido ocasiona acréscimo na energia cinética média das moléculas do gás.
O congelamento de uma substância é realizado mediante a remoção de calor da mesma, e a curva de temperatura-tempo resultante é denominada curva de congelamento. Ela é bastante semelhante à curva de aquecimento da mesma substância, sendo que é decrescente (como se houvesse sendo refletida num espelho). A remoção de energia ocasiona diminuição da energia cinética média, e durante a condensação e o congelamento, a temperatura permanece constante (pois enquanto as moléculas se
aproximam umas das outras no estado líquido e formam retículo cristalino no estado sólido, calor é liberado), enquanto a energia potencial diminui.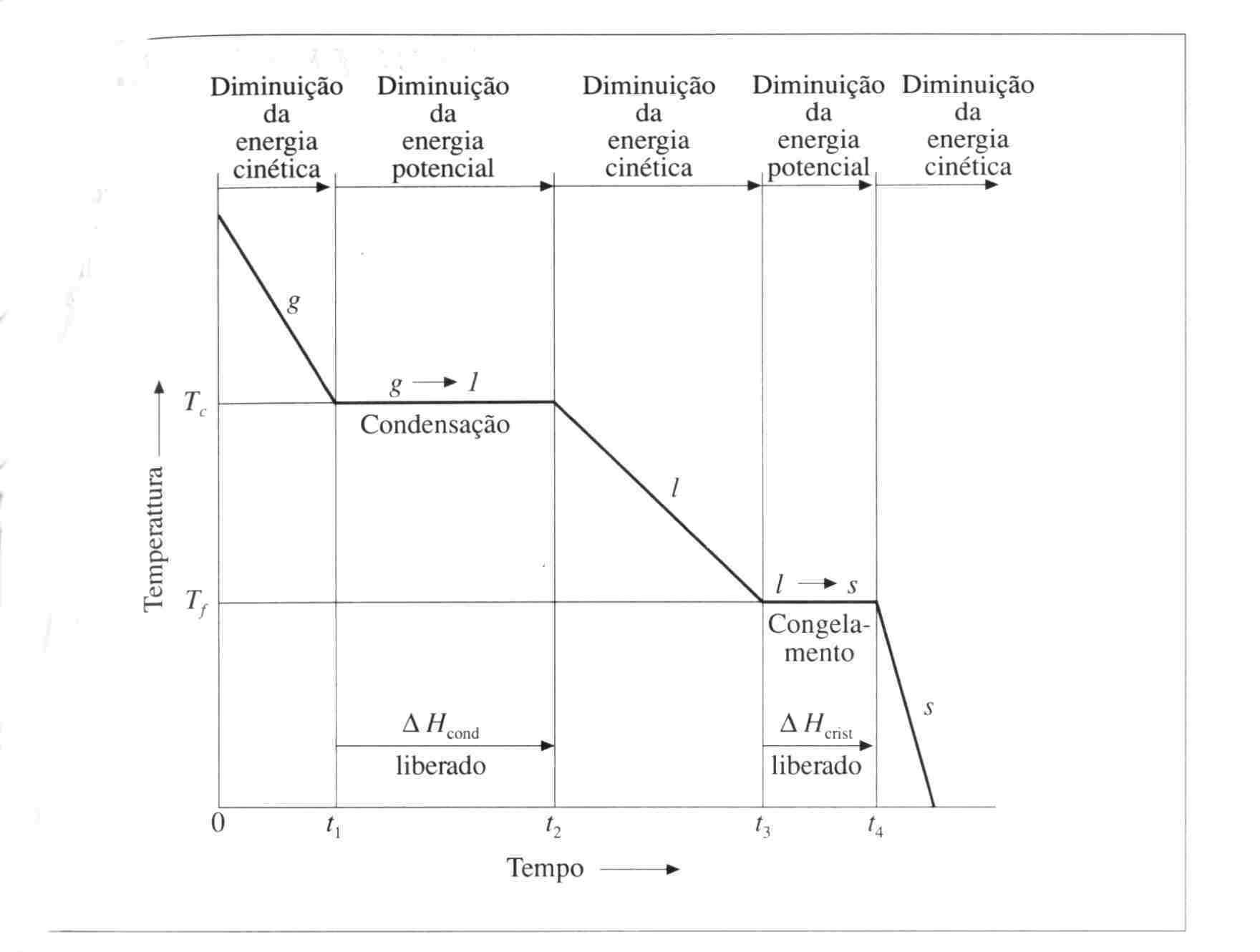
Figura 10: Curva de congelamento
Equilíbrio e o Princípio de Le Châtelier
Equilíbrio Líquido-Gás e Variações de Temperatura
Em 1884, o químico francês Henri Le Châtelier postulou que um sistema em equilíbrio mostra uma tendência a compensar os efeitos de influências perturbadoras, tais como variações de temperatura, pressão e concentração. O princípio de Le Châtelier é aplicado a qualquer tipo de equilíbrio dinâmico e pode ser expresso do seguinte modo:
Princípio de Le Châtelier: Quando um sistema em equilíbrio é sujeito a qualquer perturbação ou stress, tende a ajustar-se, ou adaptar-se, de modo a reduzir o efeito perturbador, restabelecendo a condição de equilíbrio.
O princípio de Le Châtelier é muito útil para se prever como os sistemas em equilíbrio respondem a vários tipos de perturbações. No exemplo da Figura 11, o calor fornecido tende a aumentar a pressão de vapor do líquido, o que traz o sistema temporariamente para fora da condição de equilíbrio, pois a velocidade de evaporação excede a velocidade de condensação. O resultado é uma transferência global das moléculas do líquido para a fase gasosa, o que significa que a pressão do gás aumenta. Esta, por sua vez, ocasiona um aumento na velocidade de condensação, até que finalmente (Figura 11(c)) as duas velocidades se igualam novamente. O equilíbrio é restabelecido em uma condição onde a temperatura e a pressão são maiores. A remoção de calor do sistema mostrado na figura 11 produz a resposta justamente oposta. O sistema compensa parcialmente a perturbação produzindo calor. Isto ocorre pela conversão de parte do gás em líquido, um processo exotérmico.
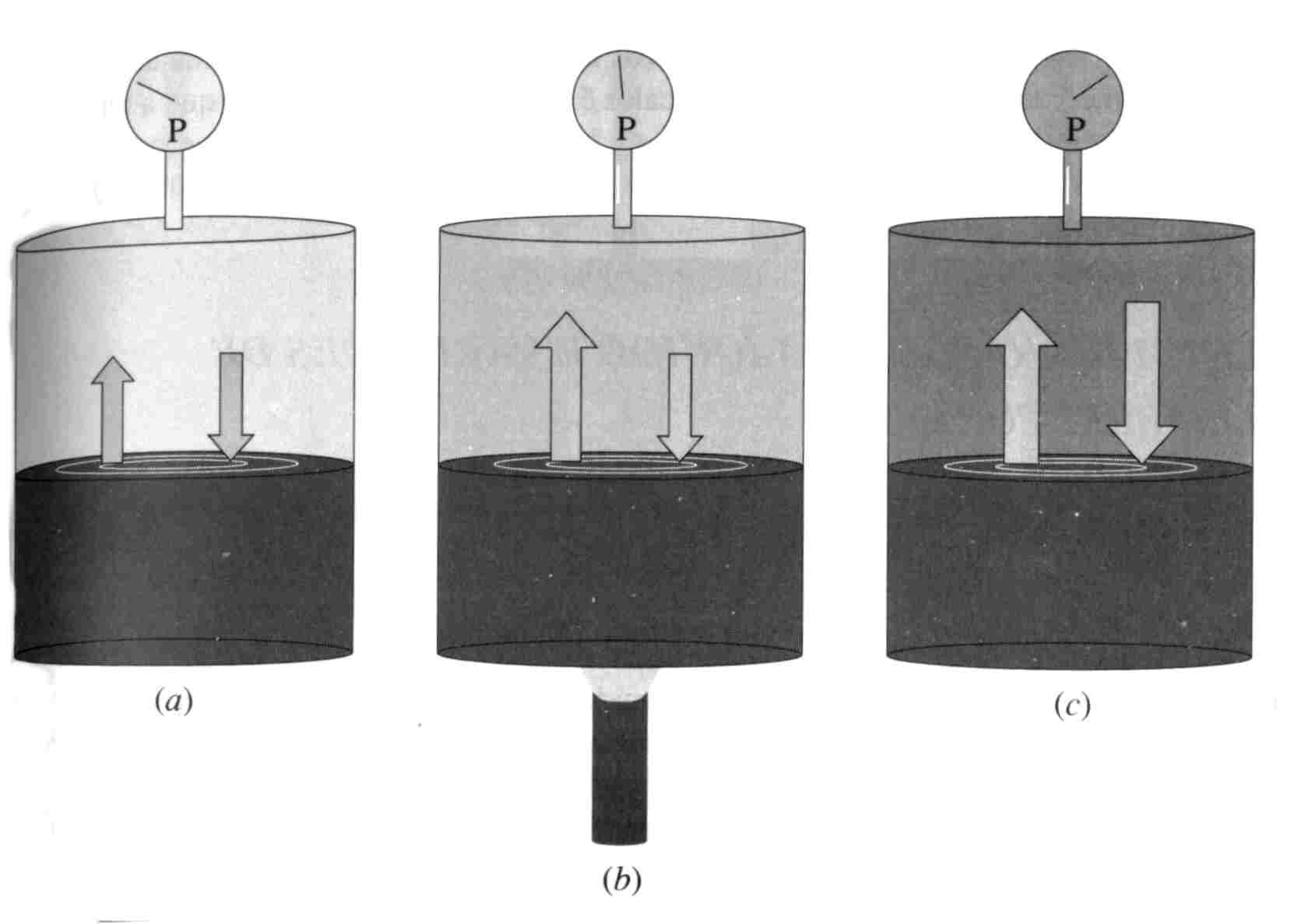
Figura 11: Efeito do aumento de temperatura em um sistema líquido-gás. (a) Antes de fornecer calor. (b) Fornecendo calor. (c) Após retornar ao equilíbrio numa temperatura mais elevada.
Equilíbrio Líquido-Gás e Variações de Pressão
O mecanismo de deslocamento do equilíbrio em função do aumento na pressão pode ser explicado como segue: o aumento na pressão do gás traz o sistema temporariamente para fora de sua condição de equilíbrio, em função do aumento na velocidade de condensação. Isto faz com que parte do gás se transforme em líquido, e o calor liberado durante a condensação ocasiona aumento na temperatura do sistema. Este processo, por sua vez, causa aumento na velocidade de evaporação do líquido, até que finalmente as duas velocidades se igualem novamente. O equilíbrio é restabelecido numa condição em que a pressão e a temperatura são maiores. Ver Figura 12.
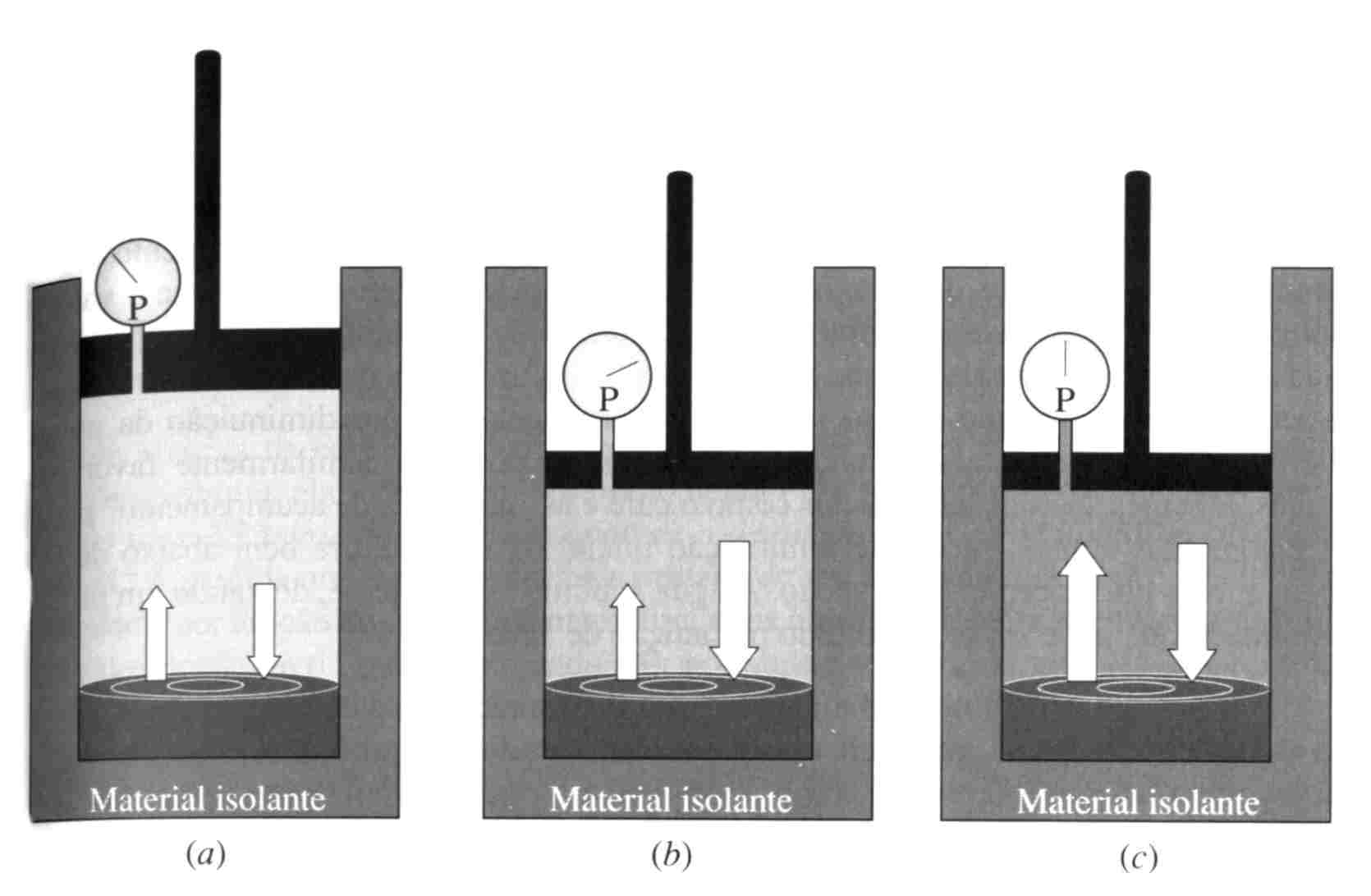
Figura 12: O efeito do aumento na pressão de um sistema líquido-gás. (a) Condição inicial de equilíbrio. (b) O êmbolo é repentinamente empurrado, aumentando a pressão. (c) O sistema retornou ao equilíbrio. A pressão e temperatura é maior que em a.
Equilíbrio Sólido-Líquido e Variações de Temperatura
Considerando a influência produzida pelo fornecimento de calor a um sistema no qual um sólido está em equilíbrio com um líquido.
O aumento gradativo da temperatura, ocasiona a formação de mais líquido, que utiliza parte do calor fornecido, minimizando o aumento na temperatura. Uma variação posterior de qualquer tipo, vai depender se a pressão e a temperatura permanecerem constantes, no processo de absorção de calor.
Com pressão constante, se a densidade do líquido for menor que a do sólido, o aumento na temperatura produz uma expansão no sistema, pois sendo o líquido menos denso que o sólido o espaço entre as moléculas é maior.
Com volume constante, a pressão final é maior que a inicial, quando a densidade do líquido é menor que a do sólido, porque a energia cinética das moléculas é maior, pois há mais espaço livre.
Se a densidade do líquido for maior que a do sólido, todas as considerações anteriores ocorrem inversamente. É o caso da água, que se expande quando congelada a pressão constante.
CURIOSIDADE:
No Vácuo quase absoluto, abaixo de 113 graus negativos o gelo volta a derreter. E permanece no estado líquido até os 123 graus negativos. Observou um físico do laboratório Nacional Pacífico Noroeste, no estado de Washington, Estados Unidos. Ele depositou vapor d’água em uma lâmina superfria, e em vez de obter cristais de gelo, formaram-se gotículas líquidas. Os cientistas não sabem ainda explicar direito por que isso acontece.(Temperatura em graus Celsius)
Equilíbrio Sólido-Líquido e Variações de Pressão
Quando a pressão de um sistema em equilíbrio é aumentada, a fase mais densa é favorecida.
Se a densidade do líquido for menor que a do sólido, forma-se mais sólido. Porque há mais espaço entre as moléculas no líquido (menos denso), o líquido se comprime e forma o sólido.
Se a densidade do líquido for maior que a do sólido, forma-se mais líquido. Nesse caso há mais espaço entre as moléculas do sólido, que se comprimindo formará líquido.
O que causa a diferença de densidade nos diferentes estados é a maneira como as moléculas interagem entre si.
A transformação direta de um sólido em um gás, sua sublimação, é análoga a evaporação de um líquido.
Assim como a velocidade de evaporação de um líquido pode ser acelerada por diminuição da pressão externa, a velocidade de sublimação de um sólido pode ser similarmente favorecida.
Quando um sólido sublima no interior de um recipiente lacrado, as moléculas do gás são depositadas na superfície do sólido, assim um estado de equilíbrio é estabelecido.
A pressão do gás em equilíbrio com seu sólido é denominada pressão de sublimação do sólido, e ela aumenta com a temperatura.
Existe uma temperatura, na qual todas as três fases podem coexistir em equilíbrio, chamada de ponto triplo, ou seja, a pressão de vapor do líquido é igual à pressão de sublimação do sólido.
É a temperatura e a pressão acima das quais desaparece a distinção entre gás e líquido.
A medida que a temperatura e a pressão de um sistema líquido-gás em equilíbrio aumentam (por adição de calor), a temperatura mais elevada, aumenta a tendência de outras moléculas deixarem o líquido formando gás; porém, a pressão mais elevada tende a forçar as moléculas no gás a se aproximarem para formar um líquido. O líquido torna-se mais semelhante ao gás, e o gás mais semelhante ao líquido. Em direção ao ponto crítico todas as propriedades tais como densidade, cor, condutividade térmica, viscosidade e índice de refração são virtualmente id6enticas nas duas fases.
A temperatura no ponto crítico é chamado temperatura crítica "TC", é a mais elevada temperatura na qual um gás pode ser liqüefeito por aumento da pressão. Essa pressão, necessária para liqüefazer um gás no seu ponto crítico é chamada pressão crítica "PC". Acima da temperatura crítica, nenhum tipo de compressão fará com que o gás torne-se a liqüefazer-se, porque o movimento das moléculas é muito violento, para que as forças intermoleculares mantenham as moléculas unidas, como no caso de um líquido. Ver Figura 13.
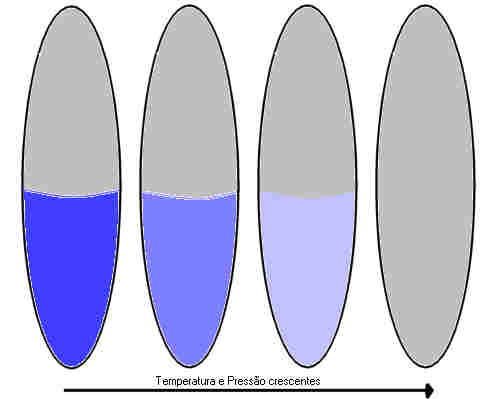
Figura 13: Comportamento próximo ao ponto crítico. Da esquerda para a direita: abaixo do ponto crítico; muito próximo ao ponto crítico; no ponto crítico; além do ponto crítico.
Líquidos são freqüentemente considerados um estado intermediário entre sólidos e gases. Este conceito é consistente com muitas de suas propriedades, que são de fato intermediárias entre as dos sólidos e as dos gases. Isto é uma consequência do fato de que nos líquidos as moléculas estão quase tão próximas quanto nos sólidos, porém estão livres para se moverem de um local para outro devido a não estarem presas dentro de um retículo cristalino.
Os líquidos evaporam e, ao fazê-lo, tornam-se mais frios. Quando a evaporação ocorre dentro de um recipiente fechado, um estado de equilíbrio dinâmico é estabelecido, no qual a velocidade de evaporação é igual à velocidade de condensação. A pressão de um gás em equilíbrio com seu líquido é chamada de pressão de vapor do líquido. O ponto de ebulição de um líquido é a temperatura na qual sua pressão de vapor torna-se igual à pressão atmosférica. Um líquido que não ebule quando atinge seu ponto de ebulição, mas continua se aquecendo além deste, é um líquido que está sofrendo o fenômeno do superaquecimento.
Alguns líquidos também supercongelam, ou seja, podem ter sua temperatura reduzida além do ponto de congelamento, sem que entretanto um retículo cristalino se forme. Os líquidos neste estado supercongelado tem as características externas semelhantes a um sólido, mas a estrutura interna desordenada de um líquido. São chamados vidros.
Líquidos que, em uma determinada faixa de temperatura, mantém uma certa ordem em suas moléculas são chamados de cristais líquidos. Os cristais líquidos encontraram na eletrônica utilizações de extrema importância, aliando suas características de mudar de consistência de acordo com a temperatura e com a voltagem aplicada a eles, promovendo assim alteração de cor. Relógios digitais, calculadoras e computadores portáteis evoluíram graças à tecnologia de utilização do cristal líquido em displays.
Um líquido é razoavelmente incompressível, e esta característica é útil em dispositivos que precisam transmitir forças à distância. A relação entre força, pressão e área ainda permite multiplicar várias vezes uma força aplicada a um ponto da via de transmissão, como por exemplo, o mecanismo de um macaco hidráulico, capaz de levantar pesos enormes com pouca força aplicada a um pistão.
Lançando mão de propriedades coligativas de líquidos em solução, como abaixamento do ponto de fusão e elevação do ponto de ebulição, é possível evitar congelamento ou superaquecimento em substâncias a determinada faixa de temperatura, como por exemplo a água usada na refrigeração de motores de automóvel.
O processo de osmose, que consiste na passagem de solvente de uma solução pouco concentrada para uma solução mais concentrada, através de uma membrana semi-permeável, é um processo vital e básico de praticamente toda célula: é um dos processos responsáveis pela vida, no formato hoje conhecido.
Russel, John Blair. (1994) Química Geral; vol. I, 2. Edição; Makron Books, São Paulo; p. 453 a 495 e 526 a 543.
Brady, James E. - Humiston, Gerard E. (1996). Química Geral; vol. I, 2. Edição; Ed. Moderna Ltda., São Paulo; p.263 a 304 e 369 a 377.
Microsoft Encarta 97 Encyclopedia, (1996)
Copyright 1993-1996, Microsoft Corporation (http://www.microsoft.com).
Bull, Martin. Liquid Crystal & Advanced Organic Materials [online]. http://www.hull.ac.uk/prospectus/chem-liquidcry.html <chem@hull.ac.uk>
Arquivo de 26 de junho de 1999.
Davidson, Patrick; Livage, Jacques; Bourgaux, Claudie. "Vanadium-pentoxide: a mineral liquid crystal that aligns itself in magnetic fields." http://www.stp-news.de/Archiv/archiv76e.html
<davidson@lps.u-psud.fr> <livage@ccr.jussieu.fr> <bourgaux@lure.u-psud.fr>
Copyright 1999, STP News [online]. (http://www.stp-news.de). Arquivo de 21 de julho de 1999.
Ehrentraut, Dr. Harald. Liquid Crystals [online].
http://wegener.mechanik.tu-darmstadt.de/harald/liquid_crystals/index.html <harald@mechanik.tu-darmstadt.de>
Arquivo de 21 de junho de 1999.
Polymers & Liquid Crystals [online]. http://abalone.cwru.edu/
Copyright 1998, Case Western Reserve University
Arquivo de 21 de julho de 1999.