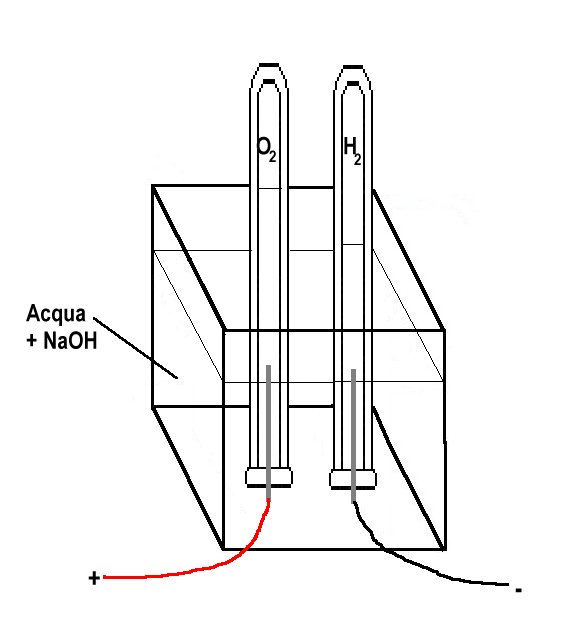
 Per effettuare l’elettrolisi dell’acqua
dovremo allestire il semplicissimo dispositivo raffigurato a
fianco.
Per effettuare l’elettrolisi dell’acqua
dovremo allestire il semplicissimo dispositivo raffigurato a
fianco.ELETTROLISI DELL’ACQUA
Tutti sanno che la formula chimica dell’acqua è H2O, il che significa che una molecola d’acqua è composta da due atomi di idrogeno ed un atomo di ossigeno. Tutti dovrebbero anche sapere che è possibile scomporre l’acqua nei suoi costituenti ricorrendo alla corrente elettrica, ed è appunto questa l’esperienza che andiamo qui a proporre.
Prima di tutto una premessa: l’acqua pura contiene, in piccolissima quantità, ioni positivi H+, in pratica atomi di idrogeno che hanno perso un elettrone e quindi hanno carica elettrica positiva (la cosa in realtà è più complessa, ma cerchiamo di tenerci sul semplice), e ioni OH-. Dato che la corrente elettrica si propaga nell’acqua grazie al movimento degli ioni e che nell’acqua distillata gli ioni sono pochissimi ne consegue che l’acqua completamente priva di sali in soluzione è una cattiva conduttrice di corrente elettrica, la presenza di sali che si scompongono in ioni aumenta moltissimo la conduttività, per questo motivo l’acqua di rubinetto, che contiene diversi materiali in soluzione, è conduttrice.
 Per effettuare l’elettrolisi dell’acqua
dovremo allestire il semplicissimo dispositivo raffigurato a
fianco.
Per effettuare l’elettrolisi dell’acqua
dovremo allestire il semplicissimo dispositivo raffigurato a
fianco.
Si prende una scatola o bacinella di materiale plastico e si praticano sul fondo due fori, attraverso questi di fanno passare i due elettrodi. Poiché l’ossigeno che si libera nella reazione reagisce con quasi tutti i metalli formando ossidi l’elettrodo al polo positivo si consumerebbe rapidamente, per questo motivo negli apparecchi professionali gli elettrodi sono fatti di platino o di un metallo ricoperto da platino, una buona soluzione di ripiego è quella di usare due pezzi di mina per matita, il materiale con cui sono costruite le mine, la grafite, è un buon conduttore e non è attaccato dall’ossigeno nascente.
Naturalmente i due fori, una volta inseriti gli elettrodi, saranno sigillati con del silicone o stucco in modo che l’acqua non esca dal recipiente. Si farà in modo che, nella parte inferiore del recipiente, la mina sporga per circa 1 cm per poter collegare i fili che vanno alla batteria.
Come fonte di corrente si usa una comune batteria da 4,5 volt
Si pone nel recipiente una certa quantità d’acqua cui è bene, per renderla più conduttiva, aggiungere qualche goccia di soluzione di idrossido di sodio (NaOH). Si riempiono d’acqua le due provette e poi, tenendo l’apertura tappata con un dito, si capovolgono, si immergono le estremità con l’apertura nell’acqua contenuta nel recipiente e poi si posiziona ciascuna provetta in modo che ognuna abbia all’interno un elettrodo.
Si collegano i due elettrodi alla pila.
All’interno delle provette cominceranno a formarsi delle bollicine di gas che andranno a raccogliersi nella parte superiore spingendo giù l’acqua. Se si aspetta un po’ di tempo si vedrà che il volume del gas che si è formato nella provetta collegata al polo negativo (Idrogeno) è doppio di quello formatosi nell’altra provetta (Ossigeno).
ATTENZIONE: se invece di impiegare NaOH per aumentare la conduttività delle soluzione si impiegano composti diversi i risultati possono non essere quelli descritti, ad esempio con una soluzione di cloruro di sodio (NaCl, il comune sale da cucina) si libera idrogeno dal polo negativo, ma al polo positivo invece che ossigeno si forma cloro che reagisce con la soluzione formando ipoclorito di sodio (NaClO) la comune candeggina.
Vai a: galvanoplastica
Torna a: CHIMICA
Torna a: Home