GALVANOPLASTICA
Come descritto nella pagina relativa all’elettrolisi molti sali in soluzione acquosa si dividono in ioni, cioè in atomi, o gruppi di atomi, dotati di carica elettrica e quindi in grado di muoversi verso degli elettrodi collegati ad una batteria.
Questo fenomeno viene impiegato per purificare metalli o per ricoprire oggetti con uno strato di metallo a scopo protettivo (nichelatura, cromatura) od ornamentale (doratura, argentatura).
Nell’esperienza qui descritta vogliamo vedere come si verifica il fenomeno. Naturalmente i risultati saranno ben diversi da quelli ottenibili con un’apparecchiatura industriale, in particolare lo strato di metallo che si depositerà sarà bel lontano dall’essere lucido ed uniforme.
Per l’esperienza ci serviranno i seguenti materiali:
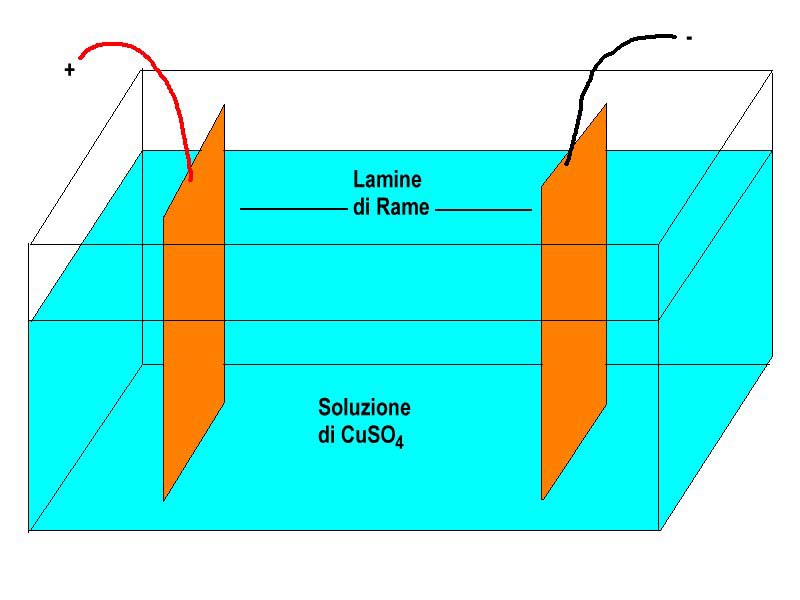
Una soluzione allo 0,5% di solfato di rame (CuSO4, il composto di colore azzurro impiegato in agricoltura e in giardinaggio), la soluzione si prepara facilmente sciogliendo 2 grammi del sale in 400 cc di acqua distillata.
Una vaschetta di vetro o di plastica.
2 lamine di rame
Una pila da 4,5 volt.
La disposizione dei componenti è visibile nella
figura.
Messa la soluzione nella vaschetta si immergono le due lamine di rame che poi si collegano alla pila.
Si osserverà che la lamina collegata al polo positivo si consuma lentamente, mentre su quella collegata al polo negativo si deposita uno strato di rame, se si prolunga l’esperienza per un certo tempo la lamina collegata al polo positivo finirà per scomparire completamente (sempre che la batteria non si scarichi nel frattempo…)
Perché succede:
il solfato di rame in soluzione si scompone in ioni rame positivi Cu++ e ioni solfato negativi SO4--. Quando si fa passare la corrente nella soluzione gli ioni Cu++ si dirigono verso il polo negativo, qui acquistano 2 elettroni (negativi), perdono la carica e si depositano come rame metallico. Gli ioni solfato si dirigono verso il polo positivo, ma non perdono i due elettroni in più che hanno, a perdere due elettroni sono gli atomi di rame della lamina metallica che passano in soluzione come ioni e successivamente andranno a depositarsi al polo negativo.
In questo modo si forma una specie di corrente di ioni rame dal polo positivo a quello negativo, flusso che continua fino all’esaurimento del rame o alla fine del passaggio di corrente.
Ponendo al polo negativo un oggetto di un metallo diverso dal rame è possibile ricoprirlo di questo metallo, per effettuare una copertura perfetta è necessario controllare accuratamente la concentrazione e la temperatura della soluzione nonché l’intensità della corrente.
Se si dispone di sali di altri metalli, ad esempio solfato di nichel o di cromo si può impiegare il procedimento descritto per nichelare o cromare oggetti metallici.
Vai a: elettrolisi
Torna a: CHIMICA
Torna a: Home