Miscugli e composti
Una classica esperienza per mostrare la differenza tra miscugli e composti. Materiale necessario:
Preparare una miscela di zolfo e polvere di ferro, si potrà facilmente vedere che i due materiali conservano inalterate le loro proprietà caratteristiche, infatti la polvere di ferro sarà attirata dalla calamita e, mettendo un po' della miscela nella provetta ed aggiungendo dell'acido cloridrico si formeranno delle bollicine di idrogeno in seguito alla reazione tra l'acido ed il ferro.

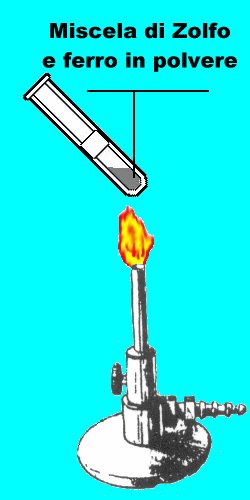
A questo punto preparate, mescolando con cura i componenti in un mortaio, una miscela di 2,7 g di polvere di ferro e 1,6 g di zolfo. Trasferite la miscela in una provetta e riscaldate sulla fiamma (avendo l'avvertenza di non tenere la provetta ferma, pena la rottura della medesima).
Tenete sulla fiamma sino a quando la miscela comincerà a diventare incandescente, a questo punto allontanate la provetta dalla fiamma, vedrete che l'incandescenza, invece di cessare, si estenderà rapidamente a tutta la massa, questo a causa della reazione esotermica tra lo zolfo e il ferro:
Fe + S à FeS
Durante il riscaldamento della miscela si sviluppano vapori di zolfo irritanti, quindi, come sempre suggeriamo, effettuate le esperienze in un ambiente che abbia un buon ricambio d'aria.
Una volta che la provetta si sarà raffreddata potrete estrarre il materiale formatosi nella reazione: si tratta di una massa di colore nero che non è attratta dalla calamita e che, se messa a contatto con acido non dà origine ad idrogeno ma ad un gas dal forte odore di uova marce. Si tratta di solfuro di ferro un composto formatosi dalla reazione chimica tra ferro e zolfo che non possiede più le proprietà tipiche dei due componenti, dopo averne usato un po' per verificarne la reazione con l'acido mettete via il resto, ci servirà per altre esperienze.
Vai a: Acido solfidrico
Torna a: CHIMICA
Torna a: Mad Scientist